
题目列表(包括答案和解析)
21.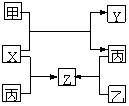 (14分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如下转化关系:
(14分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如下转化关系:
(1)若甲是短周期金属单质,乙、丙是短周期非金属单质,
X、Y、Z中只有一种是离子晶体,试推断:
①X的电子式是_______________,若丙为灰黑色
固体,则其晶体类型为_________________(分子晶体,原子晶体,混合型晶体)。
②工业上有些气体中也含有一定量的Z成分,试列举一种气体__________________。
③X与甲反应的化学方程式_____________________________________________。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是深红棕色液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出甲、乙、丙三种物质的化学式____________、____________、____________。
 ②写出X与足量的甲在溶液中完全反应的离子方程式:________________________。
②写出X与足量的甲在溶液中完全反应的离子方程式:________________________。
20.(8分) 在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)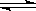 2HI(g);△H <0 反应中各物质的浓度随时间变化情况如图1:
2HI(g);△H <0 反应中各物质的浓度随时间变化情况如图1:
(1)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 ;
(2)反应达到平衡后,第8分钟时:
①若升高温度,HI浓度的变化正确 ;(用图2中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是 。(用图2中d-f的编号回答)
(3)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。


19.(7分)下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。
(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤的价电子数比元素①的价电子总数多____个。元素③氢化物分子空间构型 。
(3)元素④-般在化合物中显_____价,但与_____形成化合物时,所显价态则恰好相反。
(4)元素①单质、元素②单质和元素①②形成的合金三种物质中,熔点最低的是_____。
a.元素①单质 b.元素②单质 c.元素①②形成的合金 d.无法判断
18.(12分)氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
⑴制备氧化铜Chenlong 工业CuSO4
 CuSO4溶液
CuSO4溶液 CuSO4·5H2O
CuSO4·5H2O ……
…… CuO
CuO
①步骤I的目的是除不溶性杂质。操作是 。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是 。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是 ,过滤,水浴加热烘干。水浴加热的特点是 。
⑵探究氧化铜的性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A 和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡。结论是 。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有:
。
17.(8分)Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的实验过程:用50mL NaOH溶液吸收CO2气体制备Na2CO3。为防止通入的CO2过量而生成NaHCO3,他设计了如下步骤:(i)用25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;(ii)小心煮沸1-2分钟;(iii)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(1)他能否制得较纯净的Na2CO3?__________。理由是_______________________
________________________________________________。
(2)按他的设计,第(i)步实验装置如上图:
①装置A使用的试剂是石灰石和盐酸溶液,可否使用硫酸代替盐酸?________,原因是_________________________________________________________________。
②装置B使用的试剂是__________________,作用是______________________。
③有人认为实验步骤(ii)、(iii)的顺序对调,即先混合,再煮沸,更合理,你认为对吗?____________,为什么?_______________________________________________。
16.下列反应的离子方程式错误的是
A.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C.足量的CO2通入饱和碳酸钠溶液中:CO2+2Na++CO32-+H2O=2NaHCO3↓
D.向碳酸氢钠溶液中滴入过量澄清石灰水:
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
姓名 班级 得分
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 共86分)
15.下列实验能达到预期目的的是
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;
②用NaOH溶液除去苯中的少量苯酚;
③用饱和NaHCO3溶液除去CO2中的少量SO2;
④用加热的方法提取NH4Cl固体中混有的少量碘;
⑤用醋和澄清石灰水验证蛋壳中含有碳酸盐;
⑥用米汤检验食用加碘盐不含碘;
⑦用碘酒验证汽油中含有不饱和烃;
A.①②⑥⑦ B.①③⑤⑥⑦
C.②③⑤⑦ D.②③④⑤⑦
14.将Cu片放入0.1mol/L FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
A.3:2 B.3:5 C.4:3 D.3:4
13.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
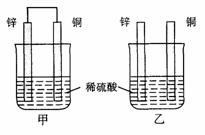 A.两烧杯中铜片表面均无气泡产生
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
12.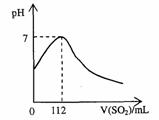 在标准状况下,向100mL氢硫酸溶液中通人二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为
在标准状况下,向100mL氢硫酸溶液中通人二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为
A.0.5mol/L B.0.05mol/L
C.1mol/L D.0.1mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com