
题目列表(包括答案和解析)
24.已知硝酸与金属反应时,在不同条件下有不同的还原产物,甚至在同一反应中可同时得到多种还原产物。现有HNO3、NH4NO3、N2O、H2O、Zn、Zn(NO3)2六种物质,
(1) 请利用其中五种物质组成一个完整的化学反应,写出该化学反应方程式:
;
(2)上述所写反应中,硝酸表现出的化学性质是 ,被还原的元素是 。
(3)若六种物质组成一个完整的化学反应,则反应中的还原产物是 (填化学式),若该反应中NH4NO3与N2O物质的量之比为1︰1,那么该反应中氧化剂与还原剂的物质的量之比为 。
(4)若六种物质组成一个完整的化学反应,且没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是 。
23.下表中所列的是六种短周期元素原子的半径及主要化合价:
|
元素代号 |
A |
B |
C |
D |
E |
G |
|
原子半径/nm |
0.089 |
0.071 |
0.117 |
0.16 |
0.074 |
0.082 |
|
主要化合价 |
+2 |
-1 |
+4,-4 |
+2 |
-2 |
+3 |
(1)C元素在周期表中的位置为 ;E原子的电子填充在 个轨道上,这些电子有 种不同的能量。
(2)B、D、E所代表元素的离子半径从大到小的顺序为 (填离子符号)。
(3)C与E形成的化合物属于 晶体。
(4)周期表中有些元素存在“对角线相似”现象(一种元素的性质常同它右下方相邻的另一种元素具有类似性),请写出A的单质与强碱溶液反应的离子方程式: 。
(5)已知X是与E同族的另一短周期元素,有人认为:H-E键的键能大于H-X键的键能,所以H2E的沸点高于H2X的沸点。你是否赞同这种观点 (填“赞同”或“不赞同”),理由: 。
22. 将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.加入合金的质量可能为6.4g B.参加反应的硝酸的物质的量为0.1mol
C.沉淀完全时消耗NaOH溶液的体积为150mL D.溶解合金时收集到NO气体的体积为2.24L
第Ⅱ卷 (共84分)
21. 常温下,海水在浓缩过程中析出盐的种类和质量(表中为每升海水析出的各种盐的克数,单位g/L)如下表:
|
海水密度 (g/mL) |
CaSO4 |
NaCl |
MgCl2 |
MgSO4 |
NaBr |
|
1.13 |
0.56 |
|
|
|
|
|
1.20 |
0.91 |
|
|
|
|
|
1.21 |
0.05 |
3.26 |
0.04 |
0.008 |
|
|
1.22 |
0.015 |
9.65 |
0.01 |
0.04 |
|
|
1.26 |
0.01 |
2.64 |
0.02 |
0.02 |
0.04 |
|
1.31 |
|
1.40 |
0.54 |
0.03 |
0.06 |
海水从密度为1.21 g/mL浓缩到密度为1.22g/mL时发生的变化是
A.各种盐的溶解度增大 B. 海水中水的质量分数减小
C.析出的粗盐中 NaCl的质量分数增大 D. 海水中Br-浓度不变
20. vmL密度为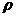 g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是
g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是
A.C=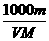 B.C=
B.C=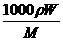 C.W%=
C.W%=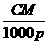 D.m=
D.m=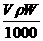
19.下列离子方程式中,错误的是
A. 氯气通入硝酸银溶液中:Cl2+H2O+Ag+→AgCl↓+H++HClO
B. 用硫酸铜溶液吸收硫化氢气体:Cu2+ + S2- → CuS↓
C. 次氯酸钠溶液中通入少量二氧化碳 ClO-+ H2O + CO2 → HCO3-+ HClO
D. 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-→ BaCO3↓+CO32-+2H2O
18.以下反应中,Q1 >Q2 的是
A.S(s)+O2(g)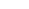 → SO2(g)+ Q1 kJ; S(g)+O2(g)
→ SO2(g)+ Q1 kJ; S(g)+O2(g)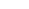 → SO2(g)+ Q2 kJ
B.2H2(g)+O2(g)
→ SO2(g)+ Q2 kJ
B.2H2(g)+O2(g)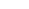 → 2H2O(l)+Q1 kJ ;2H2(g)+O2(g) → 2H2O(g)+Q2 kJ
C.NaOH(aq)+HCl(aq)
→ 2H2O(l)+Q1 kJ ;2H2(g)+O2(g) → 2H2O(g)+Q2 kJ
C.NaOH(aq)+HCl(aq)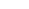 → NaCl(aq)+H2O(l)+Q1 kJ
NaOH(aq)+HAc(aq) →NaAc(aq)+H2O(l)+Q2 kJ
D.H2(g)+Cl2(g)
→ NaCl(aq)+H2O(l)+Q1 kJ
NaOH(aq)+HAc(aq) →NaAc(aq)+H2O(l)+Q2 kJ
D.H2(g)+Cl2(g)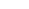 → 2HCl(g)+Q1 kJ, H2(g)+F2(g)
→ 2HCl(g)+Q1 kJ, H2(g)+F2(g)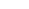 → 2HF(g)+Q2 kJ
→ 2HF(g)+Q2 kJ
17.将含有少量杂质的硝酸铜固体用酒精灯加热至恒重,收集到20.20mL气体,再将该气体用足量水吸收,剩余2.10mL气体(气体体积在同温同压下测定),则杂质不可能
A.只是NaNO3 B. 只是AgNO3 C. 只是NaCl D.是NaNO3和AgNO3的混合物
16.将Na2S 溶液逐滴加入等物质的量浓度的FeCl3溶液中,发生反应:2Fe3+ + S2- → 2Fe2+ + S ↓;将FeCl3溶液逐滴加入等物质的量浓度的Na2S溶液中,发生反应:2Fe3+ + 3S2- → Fe2S3↓ 。则以下叙述错误的是
A.Fe3+在酸性环境中氧化性较强 B.S2-在碱性环境中还原性较强
C.相同温度下Fe(OH)3的溶解度比Fe2S3大 D.往FeCl3溶液中通入H2S,有硫析出
15. 某学生根据化学知识和右表的数据,设计了以下比较物质酸性的验证实验,其中不合理的是
A.盐酸和碳酸:往碳酸钙固体中滴加盐酸,看有无气体产生
B. 碳酸与苯酚:往苯酚钠饱和溶液中,通入足量CO2,观察溶液是否变浑浊
C. 碳酸与苯酚:在苯酚悬浊液中,加入NaHCO3固体,看有无气体产生
D.碳酸氢根与苯酚:在苯酚悬浊液中,加入过量 Na2CO3溶液,观察悬浊液是否变澄清
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com