
题目列表(包括答案和解析)
2、在下列物质类别中,前者包含后者的是
A.混合物 溶液 B.电解质 化合物
C.浊液 胶体 D.单质 化合物
1、既属于钠盐又属于硫酸盐的是
A.Na2SO3 B.Na2SO4 C.Na2S D.NaOH
22.合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。
(1) 500℃、50MPa时,在容积为5L的密闭容器中加入4 mol N2、8 mol H2,反应达平衡时N2的转化率为25%,该反应的平衡常数为K,则K=__________________。
(2) 500℃、50MPa时,在容积为5L的密闭容器中,按下列配比作为起始物质,达到平衡后N2的转化率仍为25%的是_____________
A.2molN2+4molH2 B.2molN2+4molH2+ 6molHe
C.4molN2+8molH2+6molHe D.3molN2+5molH2+2molNH3
(3)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式 。
(4)合成氨工厂常通过测定反应前后混合气体的密度来确定N2的转化率。某工厂测得反应前合成塔中N2和H2混合气体的密度为0.554g·L-1,从合成塔出来的混合气体在相同条件下密度为0.693g·L-1(密度均在标准状况下测定),则该合成氨厂N2的转化率_____________。
温州中学2010学年第一学期期中考试
21. 根据下表提供的数据(常温下), 回答下列问题。
根据下表提供的数据(常温下), 回答下列问题。

(1)浓度均为0.1 mol·L-1的①Na2CO3;②NaHCO3;③NaClO的pH由大到小排列的顺序为(用编号填写)___________________________。
(2)写出NaClO溶液中通入少量CO2气体的离子方程式:
_________________________________________________________________________
(3)在CaCO3粉末中加入少量的新制氯水充分反应,写出该反应的化学方程式
__________________________________________________________________________
(4)在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度的大小关系是
_________________________________________________________________________
(5)在pH=8的NaClO和HClO混合液中,c(ClO-)/c(HClO)=_______________________
20.能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)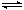 CH3OH(g)+H2O(g)
ΔH1
CH3OH(g)+H2O(g)
ΔH1
反应II:CO(g)+2H2(g)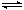 CH3OH(g) ΔH2
CH3OH(g) ΔH2
①反应I的平衡常数表达式为K=________________________
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH2________0,ΔS______0 (填“>”、“=”或“<”=)。
③对于反应II,若容器容积不变,下列措施可增加甲醇产率的是__________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.按原比例再充入 CO和 H2
④某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为_______(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-1275.6 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ΔH =-566.0 kJ·mol-1
③ H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式____________________。
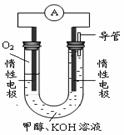 (3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池中OH-向_______极移动(填“正”或“负”)
②该电池负极的电极反应为_________________________。
③用该电池电解(惰性电极)500mL某CuSO4溶液,电解一
段时间后,为使电解质溶液恢复到原状态,需要向溶液中
加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度
为_______________,电解过程中收集到标准状况下的气体体积为__________________。
19.25℃时,物质的量浓度相等的CH3COOH和NH3·H2O的稀溶液,两者pH之和为14。
有一种并不常用的酸碱指示剂,是中性红和次甲基蓝在酒精中的混合溶液,称为“中性红-次甲基蓝混合指示剂”,它恰好能在pH=7时在溶液中呈紫蓝色,在酸性溶液中呈紫色,在碱性溶液中呈绿色。
(1)已知0.05mol·L-1NH4Cl溶液的pH=5.3,试推断0.05 mol·L-1CH3COONa溶液的pH为____。
(2)用NaOH标准溶液(准确浓度接近0.1 mol·L-1)测定待测的CH3COOH溶液浓度的实验方案中,试回答下列问题:
①中性红-次甲基蓝混合指示剂________(填“能”或“不能”)用于本实验的滴定?说明理由
________________________________________________________________________。
②常用的酸碱指示剂中__________适用于本实验的滴定。判断滴定终点的方法是________
____________________________________________________________________。
18.常温常压下,将a mol CO2气体通入1L 1 mol·L-1的NaOH溶液中,下列对所得溶液的描述不正确的是
A.当a=1/2时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
B.当1/2<a<1时,所得溶液中存在:c(Na+)>c(CO32-)+ c(HCO3-)+ c(H2CO3)
C.当a=1时,所得溶液中存在:c(OH-)+ c(CO32-)=c(H+)+ c(H2CO3)
D.当a=1时,所得溶液中存在:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
非选择题(共46分)
17.如图所示: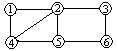 ,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应。供选择的物质有:a.铁;b.稀H2SO4;c.③Na2CO3溶液;d.BaCl2溶液;O3)2溶液;f.MgSO4溶液。图中编号④代表的物质是
,每个编号代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应。供选择的物质有:a.铁;b.稀H2SO4;c.③Na2CO3溶液;d.BaCl2溶液;O3)2溶液;f.MgSO4溶液。图中编号④代表的物质是
A.H2SO4 B.MgSO4 C.Cu(NO3)2 D.BaCl2
16.在80 g密度为d g/cm3的硫酸铁溶液中,含有2.8
g Fe3+离子,则此溶液 中SO42-的物质的量浓度为(单位为mol·L-1)
中SO42-的物质的量浓度为(单位为mol·L-1)
A.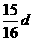 B.
B.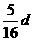 C.
C.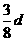 D.
D.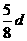
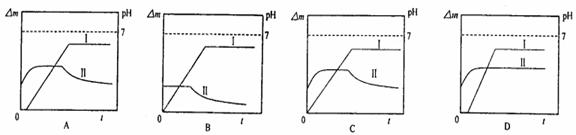
15.某同学用镀铜的石墨做阳极、石墨做阴极电解稀硫酸,用曲线I表示电解过程中阴极增加的质量(△m)随时间(t)的变化关系,用曲线II表示溶液pH随时间(t)的变化关系,下列曲线图合理的是(电解初期溶液中H+放电)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com