
题目列表(包括答案和解析)
17.在水中加入等物质的量的Ag+、Ba2+、SO42-、NO3-、Cl-、Na+,用惰性材料作电极进行电解,通电片刻后停止,下列说法不正确的是 ( )
A.电解的实质是:阳极:2Cl--2e-====Cl2↑;阴极:Ag+e-====Ag
B.电解的实质是:阳极:4OH--4e-====2H2O+O2↑;阴极:2H++2e-====H2↑
C.要恢复成电解前的溶液可以加水
D.电解产物中氧化产物和还原产物的物质的量之比为1∶2
16.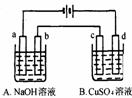 按右图装置进行电解(均是惰性电极),已知A烧杯中装有500 mL20%的NaOH溶液,B烧杯中装有500 mL
pH为6的1 mol·L-1CuSO4溶液。通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计) ( )
按右图装置进行电解(均是惰性电极),已知A烧杯中装有500 mL20%的NaOH溶液,B烧杯中装有500 mL
pH为6的1 mol·L-1CuSO4溶液。通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计) ( )
A.4 B.3
C.2 D.1
15.将等体积的0.1 mol·L-1 KHSO4溶液逐滴加入0.1 mol·L-1的Na2SO3溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中不正确的是 ( )
A.c(SO)>c(SO)>c(H+)>c(OH-)
B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=c(SO)+c(H2SO3)+c(HSO)+c(SO)
D.c(Na+)+c(K+)+c(H+)=2c(SO)+c(HSO)+c(OH-) +2c(SO)
14.观察下图装置,其中a、b是两根石墨棒,有关电极反应式错误的是 ( )
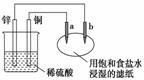
A.a电极:2Cl--2e-=Cl2↑ B.b电极:2H++2e-=H2↑
C.铜电极:2H++2e-=H2↑ D.锌电极:4OH--4e-=2H2O+O2↑
13.在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列叙述中,错误的是 ( )
A.化学反应速率:乙>甲 B.平衡后N2的浓度:乙>甲
C.H2的转化率:乙>甲 D.平衡混合气中H2的体积分数:乙>甲
12.有关①100ml 0.1 mol/L 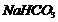 、②100ml
0.1 mol/L
、②100ml
0.1 mol/L 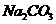 两种溶液的叙述不正确的是 ( )
两种溶液的叙述不正确的是 ( )
A.溶液中水电离出的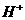 个数:②>①
个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中: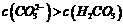
D.②溶液中: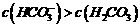
11.氢氧化镁固体在水中溶解,有下列平衡:Mg(OH)2(s) 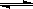 Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少 ( )
Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少 ( )
A.Na2CO3 B.MgCl2 C.NH4Cl D.NaCl
10.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32¯)、c(HCO3¯)都减少,其方法是
( )
A.加水 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
9.相同温度度,体积均为0.25L的两个恒容容器中发生可逆反应:
 X2(g)+3Y2(g) 2XY3(g)△H=-92.6kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
X2(g)+3Y2(g) 2XY3(g)△H=-92.6kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
|
容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
|
X2 |
Y2 |
XY3 |
||
|
① |
1 |
3 |
0 |
放热46.3
kJ |
|
② |
0.8 |
2.4 |
0.4 |
Q(Q>O) |
下列叙述不正确的是 ( )
A.容器①、②中反应的平衡常数相等
B.容器①、②中达到平衡时各物质的百分含量相同
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20L.则达平衡时放出的热量大于46.3kJ
8.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:
2Li++FeS+2e-====Li2S+Fe。有关该电池的下列叙述中正确的是 ( )
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为2 Li+FeS =Li2S+Fe
C.负极的电极反应式为Al-3e-===Al3+
D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-===2Li++FeS
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com