
24.(11分)某CuO粉末中混有少量Cu2O,现有一课外活动小组利用下图所示装置测定其
中Cu2O的含量,请根据图示内容回答下列问题:
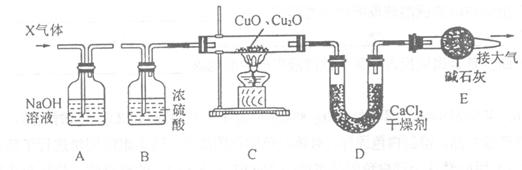
(1)X是常见还原性气体CO、H2中的一种,请根据组合装置判断X的化学式为 ,
A装置的作用是 。
(2)B装置的作用是 。若缺少它,将直接导致反应后 装置内的物质的质量偏差。
(3)已知Cu2O在加热的条件下也能被X气体还原为Cu,写出C装置中所有发生反应的化学方程式
。
(4)已知反应前CuO和Cu2O的总质量为m1 g,完全反应后U型管内物质的质量增加了m2 g(损失忽略不计),则原混合物中Cu2O的质量为 。
(5)E装置的作用是 。
(6)若进入C中的气体换成两种气体中的另外一种,同样要求用该装置完成Cu2O含量的测定实验,则D中的药品应改换为 。
279.7 mL ;
⑩再称量冷却后试管的质量为15.55 g。
根据上述实验,回答下列问题:
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其
理由是 。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致?
。
(3)在标准状况下氧气的密度为 ;混合物中MnO2的质量分
数为 。
15.95g;
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯的水面一致,再关闭弹簧夹,然后把烧杯中的水倒
掉;
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止;
⑦反应完毕后把装置放置冷却到室温;
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹;
⑨用500 mL量筒测得烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为
23.(8分)某校化学学习小组的同学测定标准状态下氧气的密度。设计了以下的实验操作步骤:
①按下图装配实验装置:
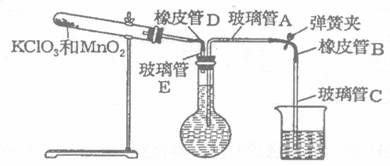
②洗净试管,然后充分干燥;
③向500 mL烧瓶里装满水,向500mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧;
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称得其质量为
22.(7分)有A、B、C、D四种元素,A的原子核外有3个电子层,且第3电子层上的电子数比第2电子层的电子数少1;B元素的某氧化物分子组成为BO3,其中B元素与氧元素的质量比为2:3,且B原子核内质子数与中子数相等;C-和D2+的电子层结构与氖原子相同。
(1)写出下列元素的元素符合:A ,C ,D 。
(2)B元素形成常见单核离子的化学符号: ,写出由该离子形成的常见化合物,如 (任写一个符合要求的化学式)。
(3)已知A元素的单质能与碘化钾(KI)溶液发生反应,生成A元素的无氧酸盐和碘单质(I2),这一反应的化学方程式为 。
21.(5分)在氯酸钾的分解反应里,二氧化锰的催化问题到目前还没有肯定的解释。鉴于制得的氧气中有氯气的气味,生成的氯化钾又混有紫红色物质,认为反应过程如下:
①2KClO3+2MnO2=2A+B+C↑ ②2A=D+ MnO2+C↑
③B+D=2KCl+( )+C↑
写出其中的化学方程式: ;
在反应中MnO2的作用是: ;
A和B的化学式分别为 和 。
20.在天平两端的烧杯中盛有等质量,等质量分数的盐酸,天平平衡。分别向一只烧杯中加入一定质量的镁,另一只烧杯中加入一定质量的铝,充分反应后,天平平衡,则加入Mg和Al的质量比可能是
A.11:12 B.32:33 C.3:4 D.1:1
第Ⅱ卷(非选择题,共60分)
19.向t℃时饱和的Na2CO3溶液中加入n g无水Na2CO3,会析出m g Na2CO3·10H2O,则(m-n)的值为
A.饱和溶液失去水的质量 B.饱和溶液失去溶质的质量
C.饱和溶液失去水和溶质的质量之和 D.其数值为0,即溶液质量不变
18.由Na、S、O、H四种元素中的二种或三种元素组成四种常见的化合物。其中甲能跟氯化钡反应生成一种硫酸盐和另一种盐,乙能跟氢氧化钠反应生成盐和水,丙能跟盐酸反应生成盐和水,丁呈中性可以氧化钙或二氧化碳发生化合反应,生成相应的碱或酸,下列说法:①甲一定是硫酸钠②乙可能是硫酸③丙一定是氢氧化钠④丁一定是水,正确的一组是
A.①②③ B.②③④ C.①③④ D.①②④
17.某有机物在氧气中完全燃烧,生成二氧化碳和水的质量比为22:9,则该有机物是
A.C2H4 B.C12H22O11 C.C6H12O6 D.C2H5OH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com