
10.下列说法正确的是
A.棉花和合成纤维的主要成分均为纤维素
B.化学反应一定伴随着能量变化,而有能量变化的不一定发生化学反应
C.温度越高,酶对某些生化反应的催化效率就越高
D.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
9.下列物质不能因发生化学反应而使溴水褪色的是
A.Mg B.NH3 C.植物油 D.甲苯
27.(6分)在密闭容器中进行的如下反应:2S02(g)+02(g)
 2S03(g)。SO2的起始浓度是4mol·L-1,02的起始浓度是1mol·L-1。当SO2的转化率为80%时,反应达到平衡状态。
2S03(g)。SO2的起始浓度是4mol·L-1,02的起始浓度是1mol·L-1。当SO2的转化率为80%时,反应达到平衡状态。
(1)求反应的平衡常数。
(2)若将平衡时反应混合物的压强增大一倍,平衡将如何移动?说明理由。
26.(8分)在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定条件下发生如下反应:H2(g)+I2(g)
 2HI(g) △H<O。反应中各物质的浓度随时间变化情况如图l所示。
2HI(g) △H<O。反应中各物质的浓度随时间变化情况如图l所示。
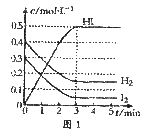
(1)该反应的化学平衡常数表达式为__________;
(2)根据图l中数据,反应开始至达到平衡时,平均速率v(HI)为_____________;
(3)反应达到平衡后第8分钟时:
①若升高温度,化学平衡常数K______(填“增大”、“减小”或“不变”),HI浓度的变化正确的是________(用图2中a-c的编号回答)。
②若加入I2,H2浓度的变化正确的是_________(用图2中d-f的编号回答)。
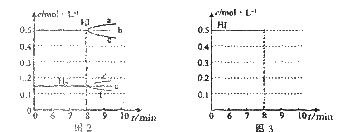
(4)反应达到平衡后第8分钟时,若把容器的容积扩大一倍,请在图3中画出第8分钟后HI浓度的变化情况。
25.(8分)某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示:
|
检测次数 |
溶液中检测出的物质 |
|
第一次 |
KCI、K2SO4、Na2C03、NaCI |
|
第二次 |
KCI、BaCl2、Na2SO4、K2C03 |
|
第三次 |
Na2SO4
、KCI、K2C03、NaCI |
请回答:
(1)三次检测结果中第____次检测结果一定不正确。
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子:
①向溶液中滴加____溶液(填化学式),其目的是_____;继续加入过量的该溶液,其目的是________;
②此时再向溶液中加入____溶液(填化学式),其目的是____。然后继续加入过量的该溶液;
③过滤,再向滤液中加入______溶液(填化学式),其目的是______。
24.(9分)25℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①
②
③
(2)溶液中共有____种不同的粒子(指分子和离子);在这些粒子中,浓度为0.002mol·L-1的是______;
(3)_______和_______两种粒子的物质的量之和等于0.01mol;
(4)在溶液中加入少量酸或碱,溶液pH_____(“发生”或“不发生”)明显变化,原因是______
23.(6分)25℃时,NaOH和Na2C03两溶液的pH均为11。
(1)两溶液中,由水电离出的c(OH-)分别是:
① NaOH中______; ②Na2C03中_______;
③在水中加入上述_______(填化学式)会使水的电离程度减小。
(2)各取10mL上述两种溶液,分别加水冲稀到100mL,pH变化较大的是________(填化学式);
(3)在已滴人酚酞的Na2CO3溶液中,逐渐滴人BaCI2溶液至过量,能观察到的现象是______
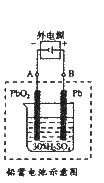
22.(7分)铅蓄电池是典型的可充型电池,电池总反应式为:
Pb+PbO2+4H++2SO22-


请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时,正极的电极反应式是_______________;电解液中H2SO4的浓度将变_____;当外电路通过1 mol电子时,理论上负极板的质量增加 ________g。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成_____、B 电极上生成_____,此时铅蓄电池的正负极的极性将________。
21.(6分)下列实验操作或对实验事实的叙述正确的是_______。(填序号)
①用碱式滴定管量取20.00mL 0.10mol·L-lKMnO4溶液;
②用托盘天平称取12.58g干燥的NaOH固体时,各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量;
③将干燥的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH;
④中和滴定中,锥形瓶用蒸馏水洗净后直接往其中注入一定量的待测溶液;
⑤把铁钉和碳棒用导线相连浸入食盐水中,碳棒上放出氯气;
⑥用吸收了CO2的固体NaOH配制的标准溶液去测定未知浓度的盐酸,测定结果偏高;
⑦配制氯化亚锡溶液时,需加少量盐酸;
⑧铁件上镀银时,应将银电极与直流电源的负极相连,用AgNO3溶液作电镀液
20.某温度下,在一容积可变的容器中,反应2A(g)+B(g)
 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2moL.和4mol。在保持温度不变的条件时下列操作可使化学平衡向右移动的是
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2moL.和4mol。在保持温度不变的条件时下列操作可使化学平衡向右移动的是
A.压强不变时,A、B和C均增加lmol
B.压强不变时,充入少量不参与反应的氖气
C.容积不变时,A、B和C均增加1mol
D.容积不变时,充入少量不参与反应的氖气
第Ⅱ卷 (非选择题 50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com