
28.(14分)已知A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的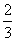 倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z。
倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z。
请回答下列问题:
(1)化合物B2A4的结构简式为______________________,一瓶无色气体,可能含有X和B2A4,或其中的一种,与一瓶Cl2混合,在一定条件下发生反应后,观察到黄绿色逐渐褪去,瓶壁上有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有X,你认为是否正确,为什么?
___________________________________________________________________________________。
②上述实验可能涉及的反应类型有___________________________________。
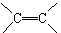 (2)含有:
的化合物与B2A4一样,在一定条件下可聚合成高分子化合物。
(2)含有:
的化合物与B2A4一样,在一定条件下可聚合成高分子化合物。
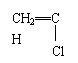 ①广泛用作农用薄膜的聚氯乙烯塑料,是由
聚合而成的,其化学方程式是
①广泛用作农用薄膜的聚氯乙烯塑料,是由
聚合而成的,其化学方程式是
 ________________________________________________________________________________。
________________________________________________________________________________。
②电器包装中大量使用的泡沫塑料的主要成份是聚苯乙烯( ),它是由
______________________(写结构简式)聚合而成。
(3)用X、D2、NaOH溶液和惰性电极,可设计为一种燃料电池。则该燃料电池的负极反应为:________________________正极反应为______________________________。
15.常温离子液体(又称常温熔融盐),是当前化学研究的热点和前沿。1914年报道的第一种离子液体硝酸乙基铵[(C2H5NH3)NO3]的熔点为l2°C。已知C2H5NH2 的化学性质与NH3相似,下列有关硝酸乙基铵的说法正确的是
A.该离子液体可以作为电池的电解质
B.硝酸乙基铵水溶液呈碱性
C.(C2H5NH3)NO3能与NaOH反应产生NH3
D.硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++H2O===C2H5NH2+H3O+
第Ⅱ卷(必做l20分+选做32分,共152分)
[必做部分]
14.在一些电视剧中,为达到一定的特级效果,经常需要“烟幕”来配合。这里所需的“烟幕”有的是用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上。使用时滴水数滴于上述混合物上即产生大量白烟,又知发生反应后有ZnO、N2、H2O生成。下列关于该反应的说法不正确的是
A.NH4NO3中,既有离子键,又有共价键
B.在常温下,将NH4NO3固体溶于水,所得的溶液的pH小于7
C.在上述化学反应中,Zn失电子的数目等于NO3─中的N得电子的数目
D.在上述化学反应中,氧化产物是ZnO和N2
13.某溶液中有Cl─、SO42─、OH─三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.③②④②① B.④②①②③ C.①②③②④ D.④②③②①
12.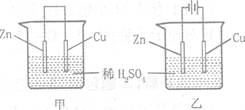 关于如图所示装置的叙述正确盼是
关于如图所示装置的叙述正确盼是
A.甲乙装置中的锌片都作负极
B.甲乙装置中的溶液内的H+在铜片上被还原
C.甲乙装置中锌片上发生的反应都是还原反应
D.甲装置中铜片上有气泡生成,乙装置中的铜片质量减少
11.等物质的量的x(g)与Y(g)在密闭容器中进行可逆反应:x(g)+Y(g) 2Z(g)+W(s)△H<0,下列叙述正确的是
2Z(g)+W(s)△H<0,下列叙述正确的是
A.平衡常数K值越小,X的转化率越大
B.达到平衡时,反应速率v正(X)===2v逆(Z)
C.达到平衡后,降低温度,正向反应速率减小的倍数小于逆向反应速率减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
10.通过复习总结,你认为下列化学知识概括合理的是
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.钢铁的吸氧腐蚀中铁是正极,在铁镀件上镀铜时铁作阳极
D.温度升高,醋酸的电离平衡向右移动,增大压强,对醋酸的电离平衡影响不大
9.下列说法正确的是
①正常雨水的pH为7.0,酸雨的pH小于7.0
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
A.①②③ 8.①④⑤ C.②③④D.③④⑤
28. (18分)氨是一种重要的基础化工原料,可以生产硝酸等一系列化工产品。德国人哈伯在1905年发明的合成氨反应原理为:
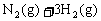
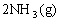 ;
;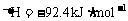
回答下列问题:
(1)将10mol 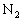 和30mol
和30mol 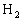 装入密闭容器中,在一定条件下反应达到平衡,若有15%的
装入密闭容器中,在一定条件下反应达到平衡,若有15%的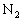 转化,则反应放出的热量是_______________kJ。
转化,则反应放出的热量是_______________kJ。
(2)工业合成氨生产中采取的措施是____________(填序号)
A. 采用较低压强
B. 采用700K左右的高温
C. 用铁触媒作催化剂
D.
将氨液化及时从混合物中分离,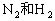 循环到合成塔中,并补充
循环到合成塔中,并补充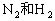
(3)用下图所示装置(夹持固定装置已略去)在实验室中模拟工业制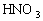
回答下列问题:
①实验时,A装置中盛放的试剂是__________________________;
装置B中反应的化学方程式为_______________________________________;
②C装置中盛放的试剂是_______________________________________;
该物质的主要作用是_______________________________________;
D装置的作用是_______________________________________;
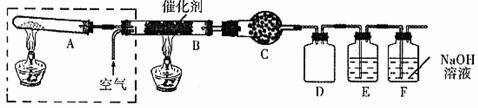
③若将上图所示装置中虚线部分换成下图所示装置进行实验。反应开始前,分液漏斗中盛放的药品是______________________;烧瓶中盛放的药品是_____________________。
27. (14分)以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题:
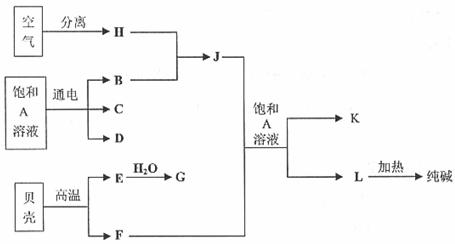
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为______________________。
(2)电解A溶液反应的离子方程式为_______________________________
(3)将F和J通入A的饱和溶液中,反应的化学方程式为:
_____________________________________________________________________
(4)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
样品m克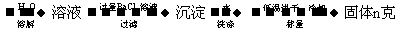
①检验沉淀是否洗涤干净的方法是___________________________________________
______________________________________________________________________________
②样品中NaCl的质量分数的数学表达式为__________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com