
11.下列实验操作中错误的是 A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 B.蒸馏操作时,应使温度计的水银球靠近蒸馏烧瓶的支管口处 C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
 D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
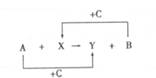
12.A 、B 、C 是单质且C 是绿色植物光合作用的产物之一,X 、Y
是化合物,他们之间的转化关系如下(反应条件略):
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
12.A 、B 、C 是单质且C 是绿色植物光合作用的产物之一,X 、Y
是化合物,他们之间的转化关系如下(反应条件略):
下列对A 、B 间的对应关系,不正确的是
A.A 是铁,B 是氢气 B.A 是碳,B 是硅 C.A 是氢气,B 是铜 D.A 是钠,B 是氢气
33.(8分)[化学-有机化学基础]
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为 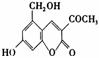 ,它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
,它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为 。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式 。
(3)下列有关“亮菌甲素”的叙述正确的是 (填序号)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4退色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1mol“亮菌甲素”最多与2molNaOH反应
(4)核磁共振仪可以测定有机物分子中处于不同化学环境的氢原子及相对数量。氢原子在分子中的化学环境不同,在核磁谱图中就处于不同的位置,化学环境相同的氢原子越多,波谱峰积分面积越大(或高度越高)。核磁共振氢谱分析,发现二甘醇分子中有3个肿收峰,其峰面积之比为2:2:1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1mol二甘醇与足量的金属钠反应生成1molH2。写出二甘醇与乙酸(按物质的量之比1:1)反应的化学方程式 。
32.(8分)[化学--物质结构与性质]
在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子的最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置 。
(2)E的气态的氢化物在同族元素中沸点最同的原因是 。
(3)A、C两元素第一电离能 > 。(填元素符号)
(4)B元素能形成多种配全物。元素之间形成配合物的条件是:一方是能够提供孤对电子的原子,另一方是 的原子。
31.(8分)[化学--化学与技术]
氨在国民经济中占有重要的地位。现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
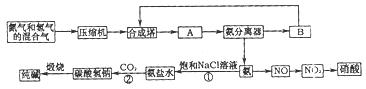
设备A的名称是 ,设备B的名称是 。
(2)硝酸厂的尾气中含有NO和NO2等污染物,为了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:Na2CO3+2NO2====NaNO2+NaNO3+CO2
但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。写出甲烷与NO2反应的化学反应方程式: 。
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。可采用 法和 法进行改进。
(4)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?为什么 。
30.(15分)氮是地球上含量丰富的一种元素,氮及其化合拖把在工农业生产、生活中有着重要作用。请回答:
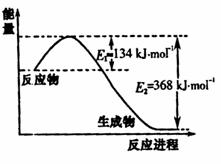 (1)右图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(1)右图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
。
(2)在一定体积的密闭容器中,进行如下化学反应:
 N2(g)+3H2(g) 2NH3(g),其化学
N2(g)+3H2(g) 2NH3(g),其化学
平衡常数K与温度t的关系如下表:
|
t/K |
298 |
398 |
498 |
… |
|
K/(mol·L-1)2 |
4.1×106 |
K1 |
K2 |
… |
完成下列问题:
①比较K1、K2的大小;K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保护不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出墁酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5·H2O+])+c(H+)= c(H+)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)>
[选做部分]
29.(12分)a、b、c、d、e、f是原子序数依次增大的6种短周期元素,a、d同主族,a是子半径最小的元素,b的最高正价与最低负价的代数和为零,a与c、d与c均可形成原子个数比为2:1和1:1的化合物,d、e的最外层电子数之和等于b的最外层电子数,f是同周期中得电子能力最强的元素。
(1)画出f元素的原子结构示意图 。在a、c、d三种元素形成的化合物中存在的化学键类型是 。
(2)写出d、e两元素的最高价氧化的水化物之间反应的离子方程式 。
(3)写出下列反应的化学方程式(有机物用结构简式表示):
①将化合物a6b6与浓硫酸和浓硝酸的混合液共热并保持(55~60)℃反应 ;
②将a6b2c和氧气的混合气体通过加热的铜网反应 。
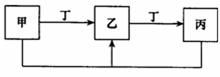 (4)甲、乙、丙、丁四种无机物具有如图所示的转化关系,甲是f的单质,且甲、乙、丙中均含有同一种元素,丁为金属单质,请写出检验乙中阳离子的一种方法:
(4)甲、乙、丙、丁四种无机物具有如图所示的转化关系,甲是f的单质,且甲、乙、丙中均含有同一种元素,丁为金属单质,请写出检验乙中阳离子的一种方法:
。
28.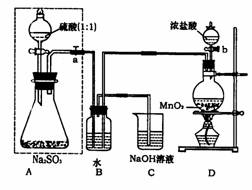 (15分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定苛无小亚硫酸钠试剂的被氧化的程度,设计了右图实验:请回答下面的问题:
(15分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定苛无小亚硫酸钠试剂的被氧化的程度,设计了右图实验:请回答下面的问题:
(1)若将虚线框内的分液漏斗换成长颈漏斗, 则应该怎样检查虚线框内装置的气密性?
。
(2)D装置中反应的化学方程式为 。B装置中反应的离子方程式为 。
(3)称量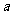 g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为
。
g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为
。
(4)C装置中反应的离子方程式为 。
(5)现有以下试剂:蒸馏水、稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法测定试样中无水亚硫酸钠被氧化的程度
。
15.近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是 ( )
A.乙醇在电池的负极上参加反应
B.1mol CH3CH2OH被氧化转移6mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应为4H++O2+4e-→2H2O
第Ⅱ卷(必做120分+选做32分,共152分)
|
14.下列有关化学用语的叙述正确的是 ( )
 A.硫酸铝水解的化学方程式是:Al2(SO4)3+3H2O 2Al(OH)3+3H2SO4
A.硫酸铝水解的化学方程式是:Al2(SO4)3+3H2O 2Al(OH)3+3H2SO4
B.铜跟浓硝酸反应的离子方程式是:
Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
C.钢铁发生吸氧腐蚀时,负极发生的电极的反应为:2H2O+O2+4e-→4OH-
D.氢氧化亚铁在空气中久置变成红褐色的化学方程式为:
4Fe(OH)2+O2+2H2O 4Fe(OH)3
13.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂。已知它的结构式为Cl-S-S-Cl,易与水反应:2S2Cl2+2H2O 4HCl+SO2↑+2S↓。对该反应下列说法正确的是 ( )
A.S2Cl2既作氧化剂又作还原剂
B.S2Cl2只作氧化剂
C.每生成1mol SO2转移4mol电子
D.S2Cl2只作还原剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com