
17.(8分)现有常温下的0.1mol·L-1CH3COONa溶液
(1)该溶液呈碱性的原因是(用离子方程式表示):__________________________;为证明上述观点,甲同学设计了如下实验:取少量上述CH3COONa溶液,向其中滴加数滴酚酞试液后,溶液显浅红色;将上述浅红色溶液加热,观察到_____________现象,则说明上述观点正确。
(2)乙同学就该溶液中粒子浓度之间的关系写出了下列关系式,请你为其补充完整: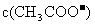 +________=0.1mol·L-1
+________=0.1mol·L-1
(3)丙同学认为该溶液中CH3COONa的水解是微弱的,发生水解的CH3COO-离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。______________________________________________________________________________________________________。
15.在一定条件下,利用电解的方法可以将含有少量Fe、Zn、Cu、Pt等金属杂质的粗镍提纯。已知氧化性:Fe2+<Ni2+<Cu2+,则下列叙述正确的是
A.纯镍作阳极
B.阳极发生还原反应
C.粗镍连接电源的正极,其电极反应为: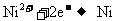
D.电解后,电解槽底部的阳极泥中含有Cu和Pt等金属杂质
第Ⅱ卷(非选择题, 60分)
(1)三种短周期金属元素原子的电离能数据见下表:
|
电离能/kJ·mol-1 |
X |
Y |
Z |
|
I1 |
519 |
502 |
580 |
|
I2 |
7296 |
4570 |
1820 |
|
I3 |
11799 |
6920 |
2750 |
|
I4 |
-- |
9550 |
11600 |
分析表中数据可知,X的元素符号是_________,Z元素常见的最高正价是________。
(2)下图是短周期元素的单质熔点的变化图。
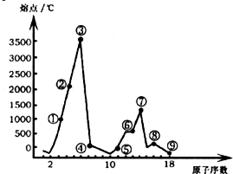
元素③和⑦对应的单质,其晶体类型相同,都属于________晶体;元素④的气态氢化物是含有________键(填“极性”或“非极性”)的________分子(填“极性”或“非极性”);元素②能够与氟元素形成原子个数比为1:3的化合物,该化合物为非极性分子,则该分子的空间构型为________________;元素⑤、⑥的最高价氧化物对应的水化物之间发生反应的离子方程式为________________。
(3)下表列出了一些共价键的键长数据:
|
|
C-F |
C-Cl |
C-Br |
C-I |
C-C |
C-Si |
|
键长/pm |
98 |
161 |
182 |
204 |
154 |
170 |
①CF4、CCl4、CBr4、Cl4 四种物质中热稳定性最强的是________(填化学式),沸点最高的是________(填化学式)。
②四氯化碳常温下为液体,金刚石的熔点为3350℃,碳化硅的熔点为2600℃,造成这三种物质熔点差异的原因是____________________________________________。
14.分析下图所示的四个装置,下列判断正确的是

A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中A1电极反应式为: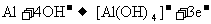
C.(3)是一个电镀装置
D.(4)中Cu电极反应式为: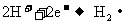
13.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是,反应中物质和水分别解离成电性相反的两部分,然后异种电性的部分两两重新组合成新的物质。根据上述信息判断,下列说法不正确的是
A.PCl3(P为+3价)的水解产物是H3PO3和HCl
B.Mg3N2的水解产物是NH3(或NH3·H2O)和Mg(OH)2
C.NCl3(C1为+1价)的水解产物是HCl和HNO3
D.CuCl2的水解产物是Cu(OH)2和HCl
12.在恒温恒容的密闭容器中,建立如下平衡: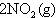

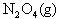 。在相同条件下,若再向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器中NO2的体积分数比原平衡时
。在相同条件下,若再向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器中NO2的体积分数比原平衡时
A.都增大 B.都减少
C.前者增大,后者减小 D.前者减小,后者增大
11.下列说法一定正确的是
A.水分子中氧原子的原子轨道采用sp2杂化
B.在形成共价键时,原子轨道重叠越多,电子在核间出现的概率越大,所形成的共价 键越牢固
C.SiO2晶体的网状结构中,由共价键形成的最小环上有8个原子
D.前三周期中,基态原子的未成对电子数等于周期序数的元素共有5种
10.下列叙述中正确的是
A.一定温度下,AgCl的饱和水溶液中,[Ag+]和[C1-]的乘积是一个常数
B.任何AgCl溶液中,c(Ag+)和C(C1-)的乘积都等于Ksp(AgCl)
C.AgCl水溶液的导电性很弱,所以AgCl为弱电解质
D.若Ksp(AgI)<Ksp(AgCl),则AgI沉淀易转化为AgCl沉淀
9.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③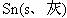
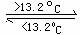
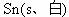 △H3=2.1kJ·mol-1
△H3=2.1kJ·mol-1
下列说法正确的是
A.△Hl<△H2
B.在常温下,白锡比灰锡稳定
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2℃的环境中,不会自行毁坏
8.在密闭容器中,一氧化碳与水蒸气发生如下反应:
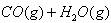

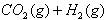 ,该反应在800℃时的平衡常数是1.0,如果反应开始时,一氧化碳和水蒸气的浓度都是lmol·L-1,则一氧化碳在此条件下的平衡转化率是
,该反应在800℃时的平衡常数是1.0,如果反应开始时,一氧化碳和水蒸气的浓度都是lmol·L-1,则一氧化碳在此条件下的平衡转化率是
A.90% B.75% C.50% D.25%
7.下列有关说法正确的是
A.含有阳离子的晶体一定含有阴离子
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.氯化铵晶体中既含有离子键,又含有配位键和共价键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com