
7.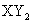 是离子化合物。其中阴、阳离子的电子层结构都与氖原子相同,则X、Y为
是离子化合物。其中阴、阳离子的电子层结构都与氖原子相同,则X、Y为
A.Na和Cl B.K和S C.Ca和F D.Mg和F
6.下列说法正确的是
A.非金属原子间不可能形成离子键
B.只有不同的原子问才能形成共价键
C.共价化合物中不可能含离子键
D.离子化合物中不可能含有共价键
5.根据下列微粒结构示意图的共同特征,可以把
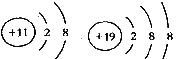
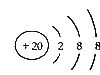
三种微粒归为一类。下列微粒中可以与上述微粒归为一类的是

4.运用元素周期律分析下面推断,其中错误的是
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为有色固体,HAt不稳定,AgAt感光性很强,不溶于水也不溶于酸
C.硫酸锶(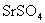 )是难溶于水的白色固体
)是难溶于水的白色固体
D.硒化氢(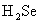 )是有色、有毒的气体,比
)是有色、有毒的气体,比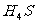 稳定
稳定
3.下列关于原子结构的叙述正确的是
A.所有的原子核都是由质子和中子组成的
B.原子的最外层电子数不超过8个
C.稀有气体原子的最外层电子数均为8
D.原子的次外层电子数都是8
2.已知2H→H2放出437.6kJ的热量,下列说法正确的是
A.氢气分子内每个氢原子都达到了8电子稳定结构
B.1mol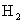 离解成2tool H要放出437.6kJ热量
离解成2tool H要放出437.6kJ热量
C.1mol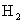 的能量比2mol H的能量低
的能量比2mol H的能量低
D.氢原子的活泼性比氢分子弱
1.下列化学电池不易造成环境污染的是
A.氢氧燃料电池 B.锌锰电池 C.镍镉电池 D.锂电池
23.(7分) 某离子晶体晶胞结构如下图所示,X位于立方体的顶点,Y位于立方体中心,试分析:
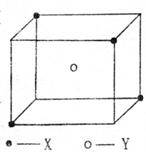
(1) 晶体中每个X同时吸引着____________个Y,该晶体的化学式为____________。
(2) 晶体中在每个X周围与它最接近且距离相等的X共有____________个。
(3) 晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为____________。
(4) 设该晶体的摩尔质量为M g·mol-1,晶体密度为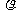 g·cm-3,阿伏加德罗常数为NA,则晶体中两个距离最近的X中心间的距离为____________。
g·cm-3,阿伏加德罗常数为NA,则晶体中两个距离最近的X中心间的距离为____________。
22.(10分) 在一定温度下,将2 mol A气体和2 mol B气体混合于一个2L的密闭容器中,发生反应 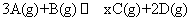 。在2min末生成了0.8 mol D,并测得此时C的浓度为0.4 mol·L-1由此计算
。在2min末生成了0.8 mol D,并测得此时C的浓度为0.4 mol·L-1由此计算
(1)  。
。
(2) 在2min内以D物质表示的反应速率为________________________。
(3) 此时A物质的转化率为________________________。
(4) 已知在该温度下,该反应的化学平衡常数K=1,则该反应在2min末是否达到了化学平衡状态________________________。
(5) 如果上述反应在相同条件下从逆反应开始进行,开始时加入C和D各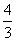 mol,若要使平衡时各物质的质量分数与原平衡完全相同,则还应该加入B物质的量为____________mol。
mol,若要使平衡时各物质的质量分数与原平衡完全相同,则还应该加入B物质的量为____________mol。
21.(10分) 某温度(t℃)时,水的离子积为KW=1×10-13,则该温度(选填“大于”、“小于”或“等于”) ____________25℃,其理由是____________________________________________________________________________________________________________________________________________________________________________。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1) 若所得混合液为中性,则a∶b=____________。
(2) 若所得混合液的pH=2,则a∶b=____________,此溶液中各种离子的浓度由大到小排列顺序是____________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com