
29.(14分)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2 (SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。
已知:SO2+2Fe3++2H2O=SO2-4+2Fe2++4H+
Cr2O2-7+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程 式: 。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸质量为 t,SO2全部转化为H2SO4时放出的热量是 kJ。
28.(19分)二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃-140℃与硫反应,即要得S2Cl2粗晶。
②有关物质的部分性质如下表:
|
物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
|
S |
112.8 |
444.6 |
略 |
|
S2Cl2 |
-77 |
137 |
遇水生成HCl、SO2、S; 300℃以上完全分解; S2Cl2+Cl2 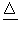 2SCl2 2SCl2 |
设计实验装置图如下:
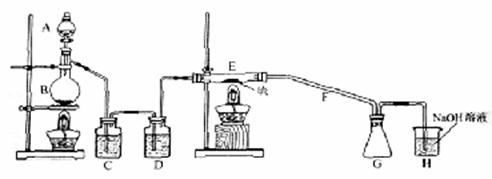
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见
。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式: ;
E中反应的化学方程式: 。
(3)C、D中的试剂分别是 、 。
(4)仪器A、B的名称分别是 、 ,F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 ,在F中可能出现的现象是 。
(6)S2Cl2粗品中可能混有的杂质是(填写两种) 、 ,为了提高S2Cl2的纯度,关键的操作是控制好温度和 。
27.(19分)奶油中有一种只含C、H、O的化合物A。A可用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1。
(1)A的分子式为 。
(2)写出与A分子式相同的所有酯的结构简式:
。
已知:①ROH+HBr(氢溴酸)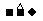 RBr+H2O
RBr+H2O
②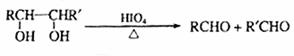
A中含有碳氧双键,与A相关的反应如下:
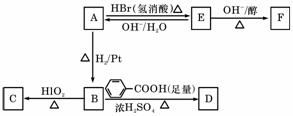
(3)写出A→E、E→F的反应类型:A→E 、E→F 。(4)写出A、C、F的结构简式:A 、C 、 F 。
(5)写出B→D反应的化学方程式:
(6)在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式: 。 。A→G的反应类型为 。
26.(14分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为 ;XW的电子式为 ;Z元素在周期表中的位置是 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式) ;V、W的氢化物分子结合H+能力较强的是(写化学式) ;用一个离子方程式加以证明 。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为 ,由此可知VW和YW2还原性较强的是(写化学式) 。
13.天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时,LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6=CoO2+LiC6,下列说法正确的是
A.充电时,电池的负极反应为LiC6-e-=Li++C6
B.放电时,电池的正极反应为CoO2+Li++e-=LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
第Ⅱ卷
12.下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室生产的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
11.25℃时,水的电离可达到平衡:H2O=H++OH-;△H>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH)-降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
10.草酸是二元中强酸,草酸氢钠溶液显碱性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2 mol/L
B.V(NaOH)<10 mL时,不可能存在c(Na+)=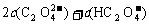
C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
D.V(NaOH)>10 mL时,c(Na+)>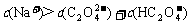
9.下列关于粒子结构的描述不正确的是
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含有一个极性键的18电子粒子
C.CH2Cl2和CCl4均是四面体构型的非极性分子
D.1 mol 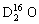 中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
8.为达到预期的实验目的,下列操作正确的是
A.欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4·7H2O溶解在90 g水中
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com