
21.(6分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00mL甲溶液,向其中缓慢滴入乙溶液15.00mL,共收集到224mL(标准状况)气体
②量取15.00mL乙溶液,向其中缓慢滴入甲溶液25.00mL,共收集到112mL(标准状况)气体。
(1)判断:甲是 溶液,乙是 溶液。
(2)实验2中所发生反应的离子方程式为 、 。
(3)甲溶液的物质的量浓度为 ,乙溶液的物质的量浓度为 。
20.(6分)中学常见的A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转
化关系,所有反应物和生成物均已给出。
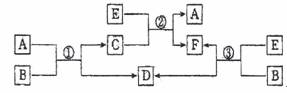
(1)若B是水,C是一种有磁性的黑色化合物,则反应①的化学方程式为 。
(2)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。反应②的化学方程式是 ,在反应③中,若生成1mol D,则转移电子数目为 。
(3)若反应①、②、③均为水溶液的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱顺序为 ,其中A的化学式是 。
19.(5分)(1)写出表示含有6个质子、8个中子的原子的化学符号 。
(2)周期表中最活泼的金属元素位于第 纵行。
(3)所含元素中18种的周期是第 周期。
18.(9分)下图为某实验者设计的验证银圆(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图。常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在。
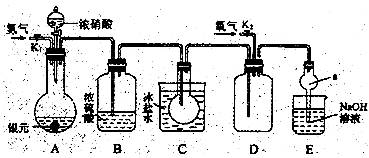
(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是 。
(2)若装置中缺B,其后果是 。
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是 。
(4)C装置的作用是 ;E中a仪器所起的作用是 。
(5)已知该银圆的质量为25g,加入75mL 12mol·L-1的浓硝酸。实验结束后,A中烧瓶内溶液中H+的浓度为2mol·L-1(反应中HNO3既无挥发也无分解),溶液体积仍为75mL。
①参加反应的硝酸的物质的量是 。
②为测定该银圆中铜的质量分数,还需进行的主要实验操作是 。
17.(8分)如图所示实验装置是验证氯化铵受热分解的产物是氨气和氯化氢气体,并将分解产物重新化合生成氯化铵。
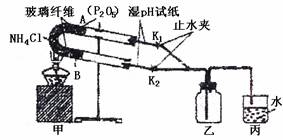
(1)U型管B处所盛放的固体物质是 。
(2)证明氯化铵的分解产物分别是氯化氢和氨气的操作(控制活塞操作)和现象是:
① ,当 说明有NH3气体生成。
② ,当 说明有HCl生成。
(3)若要在乙瓶中观察HCl和NH3重新化合和成NH4Cl的实验现象,某学生的实验操作为;关闭止水夹K1,打开止水夹K2,当丙中导管口有白雾生成时,关闭止水夹K2,打开止水夹K1,即可观察到实验现象,你认为该学生的实验操作是否正确?为什么?
16.如下图所示,一定条件下将1mol A2气体和3mol B2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2(g)+3B2(g)
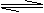 2AB3(g)。当反应达到平衡时,活塞位置如图2所示,则平衡时A2的转化率是
( )
2AB3(g)。当反应达到平衡时,活塞位置如图2所示,则平衡时A2的转化率是
( )
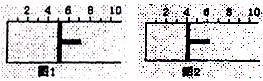
A.20% B.40% C.60% D.无法确定
|
15.把CO2分别通入到①Ba(NO3)2溶液、②Ba(OH)2溶液、③溶有氨的BaCl2溶液、④苯酚钠饱和溶液、⑤氯化钙溶液中,可能观察到白色沉淀或产生浑浊的溶液是 ( )
A.②和③ B.②和④ C.②③④ D.①③⑤
14.有①、②、③三瓶体积相等,浓度都是1mol/L的HCl溶液,将①加热蒸发至体积减小一半,在②中加 CH3COONa固体(加入后溶液仍呈酸性),③不作改变,然后以酚酞作指示剂,用溶液滴定上述三种溶液,消耗的NaOH溶液的体积是 ( )
A.①=③>② B.③>②>① C.①=②=③ D.①<②=③
13.X是由两种短周期元素构成的离子化合物,1mol X含有20 mol 电子。下列说法不正确的是 ( )
A.晶体中阳离子和阴离子所含电子数一定相等
B.晶体中一定只有离子键没有共价键
C.所含元素一定不在同一周期也不在第一周期
D.晶体中阳离子半径一定小于阴离子半径
12.下列有关试剂的保存方法,错误的是 ( )
A.浓硝酸通常保存在棕色玻璃试剂瓶中
B.过氧化钠盛放于塑料袋内,并保存在密闭的容器中
C.氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中
D.新帽的氯水保存在无色玻璃试剂瓶中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com