
13.a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是( )
A.(b-2a)mol B.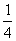 b mol
C.
b mol
C.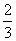 a mol
D.2a mol
a mol
D.2a mol
12.下列五种有色溶液与SO2作用,均能褪色,其实质相同的是 ( )
①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴有酚酞的NaOH溶液
A.①④ B.②③ C.①③ D.②④
11.下列反应的离子方程式书写正确的是 ( )
A.硫酸铝溶液中加入少量氢氧化钠溶液 Al3++4OH-=AlO2-+H2O
B.氯气通入氢氧化钠溶液 Cl2+2OH-=Cl-+ClO-+H2O
C.碳酸钙与醋酸反应 CaCO3+2H+=Ca2++CO2↑+H2O
D.将铁粉加入到三氯化铁溶液中 Fe+Fe3+=2Fe2+
9.只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是 ( )
A.Ba(OH)2溶液 B.H2SO4溶液 C.NaOH溶液 D.AgNO3溶液
|
A.84g碳酸氢钠晶体中含CO32-为NA个
B.100mL 1.0mol/L NH4NO3溶液中含铵根离子0.1NA个
C.标准状况下,22.4L甲烷和氢气的混合物所含分子数为NA个
D.1mol Cl2参加反应,转移的电子数一定为2NA个
8.下列说法正确的是 ( )
A.卤素单质(X2)跟水反应的通式是X2+H2O=HX+HXO
B.液溴保存在煤油中
C.漂白粉的有效成分是次氯酸钙
D.光照氯水有气泡逸出,该气体是Cl2
7.光纤通信是70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光学纤维是由下列哪种物质经特殊工艺制成的 ( )
A.石墨 B.二氧化硅 C.氧化镁 D.氧化铝
32.一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L─1的NaOH溶液(密度为1.12 g·cm─3)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
⑴ 原NaOH溶液溶质的质量分数为 ;
⑵ 所得溶液中Cl─的物质的量为 ;
⑶ 所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2) = ;
⑷ 若标准状况下a L H2和Cl2的混合气体经光照充分反应后,所得气体恰好使溶液中b mol NaOH完全转化为盐,则a、b的关系是 。
31.(6分)某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl4, 振荡后静置,观察到下层液体呈紫红色;②取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。
(1)写出实验②中发生氧化还原反应的离子方程式_____________________________;
(2)由上述两个实验,对物质的氧化性强弱的比较可以得出的结论是(填序号)_______;
A.Br2>I2 B.Fe3+>Br2 C.Br2>Fe3+ D.I─>Br─
(3)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明。①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉液
(提示:请写出实验步骤、现象及结论)___________________________ __
______________________________________________________________________。
30.(13分)为了探究硫化钠晶体(Na2S·nH2O)在空气中的变化,某兴趣小组的实验步骤及现象记录如下:①将少量硫化钠晶体置于表面皿上,暴露在空气中。②三天后将样品放入盛水的烧杯中,搅拌后得到无色澄清溶液。③取少量该溶液加入过量盐酸中,有气体放出,且溶液保持澄清。 ⑴请你根据上述记录猜想实验③中所放出气体的成分可能是(至少写出三种)]
。
⑵若所放出的气体为两种气体的混合气体,请利用以下装置探究混合气体的成分:
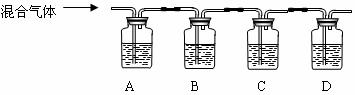
供选试剂为:澄清石灰水、品红溶液、浓溴水(试剂可重复使用)
①指出各瓶的试剂:
A___________B_____________C____________D____________。
②若A中现象为_______________________,则混合气体为______________________; 若A中现象为____________________,则混合气体为________________________;
③写出以上两种情况下B瓶中反应的化学方程式:____________________________;
_________________________________________________。
④本实验中浓溴水还可用(写名称)___________________________代替。
29.(10分)A、B、C、D为中学化学中常见的四种单质。
(1)已知在空气中A约占21%(为体积分数)、C易溶于CS2但不能在空气中自燃;D
在标准状况下的密度为3.170 g·L─1。分别写出A、C、D的化学式:A 、
C 、D 。工业上制取C的氧化物的反应化学方程式为:
。
(2)在一定条件下B与A、C、D化合分别生成甲、乙、丙。已知乙、丙分子中含有的电子数均与K+相同。乙的化学式是:乙 ;丙的电子式是: 。
(3)C可以发生如下图所示一系列转化(无关物质及反应条件已略)
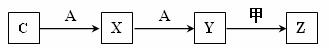
足量的单质A与化合物乙反应的化学方程式 。
Z的浓溶液与铜粉在加热的条件下反应,当反应中有1.806×1024个电子转移时,
被还原的Z物质的量是 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com