
19.下列反应的离子方程式书写正确的是 ( )
A.FeCl2溶液中加入足量硫酸酸化的高锰酸钾溶液
5Fe2++MnO-4+8H+→5Fe3++Mn2++4H2O
B.在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):
HSO-3+Br2+H2O→3H++2Br-+SO2-4
C.在碳酸氢铵溶液中加入足量NaOH溶液共热:NH+4+OH-→NH3↑+H2O
D.在硝酸银溶液中加入过量氨水: Ag++NH3·H2O→AgOH↓+NH+4
18.分别在PH=1的酸溶液和PH=14的NaOH溶液中加入足量的铝粉,放出H2的量前者多,其原因可能是 ( )
A.两者溶液的体积相同,而酸是多元强酸
B.酸是强酸,且酸溶液的浓度比NaOH溶液的浓度大
C.两者溶液的体积相同,酸是弱酸
D.酸溶液的体积与NaOH溶液的体积相等
17.物质的量浓度相同的200mL Ba(OH)2溶液和15mL NaHCO3混合后,最终溶液中各离子的物质的量浓度关系正确的是 ( )
A.[OH-]>[Ba2+]>[Na+]>[CO2-3] B.[Na+]>[OH-]>[Ba2+]>[H+]
C.[OH-]=[Ba2+]+[Na+]+[H+] D.[H+]+[Na+]+2[Ba2+]=[OH-]
16.下列化工生产原理的几种叙述中,不符合目前工业生产实际情况是 ( )
A.在加热条件下,用浓H2SO4和磷矿石反应制磷酸
B.SO2在接触室氧化成SO3,再在吸收塔内用水吸收制成浓硫酸
C.将Cl2在H2中燃烧生成氯化氢,用水吸收制成盐酸
D.用Mg(NO3)2作吸水剂,将稀硝酸蒸馏浓缩至96%以上的浓HNO3
15.甲溶液PH值是乙溶液PH值的2倍,则甲溶液中[H+]与乙溶液中的[H+]之比为( )
A.一定是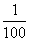 B.一定是
B.一定是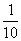 C.一定是
C.一定是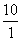 D.无法确定
D.无法确定
14.下列说法错误的是 ( )
A.0.2mol/L的NaHCO3溶液中:[Na+]>[HCO-3]>[OH-]>[H+]
B.在大试管中加入5~10mL 1mol/L HCl,再加入1mL水玻璃,然后用力振荡,可制得硅酸溶胶
C.向氨水中逐滴入盐酸至溶液的pH=7,则混合液中:[NH+4]=[Cl-]
D.pH=3的NaOH溶液与pH=1的醋酸溶液等体积混合所得溶液的pH>7
13.在无色的酸性溶液可以大量共存的离子组是 ( )
A.K+、S2O2-3、OH-、Na+ B.Mg2+、SO2-4、Al3+、HCOO
C.Na+、Al3+、Mg2+、NO-3 D.K+、Fe2+、Cl-、NO-3
12.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是 ( )
A.将SO2通入水中 B.火碱溶于水
C.将HCl通入水中 D.硫酸氢钠溶于水
11.超临界液体是物质介于气态和液态之间的一种新的状态。目前应用最广的是超临界二氧化碳,在化学工业中可取代氟利昂等溶剂、发泡剂。下列有关超临界二氧化碳的说法中错误的是 ( )
A.超临界二氧化碳是新合成的一种物质
B.超临界二氧化碳由CO2分子组成
C.用超临界二氧化碳溶解物质后,可在常温常压使二氧化碳挥发将其除去
D.用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏
9.为了确定某物质是否变质,所选试剂(括号内物质)达不到实验要求的是 ( )
A.K2SO3是否被氧化(BaCl2) B.FeSO4是否被氧化(KSCN)
C.KI是否被氧化(淀粉溶液) D.漂粉精是否变质(盐酸)
|
A.O2即不是氧化产物,又不是还原产物
B.该反应的电子转移总数为2e
C.氧化产物与还原产物物质的量之比为1:1
D.有1molI2生成时,被还原的O3的物质的量为1mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com