
9.硫氰(SCN)2其化学性质与卤素单质很相似,称之为拟卤素,拟卤素离子和卤离子还原性强弱的顺序为:Cl-<Br-<SCN-<I-,下列方程式不正确的是 ( )
A.(SCN)2+2Br-=Br2+2SCN-
B.(SCN)2+H2S=H++2SCN-+S
C.(SCN)2+2I-=2SCN-+I2
D.4H++2SCN-+MnO2 Mn2++(SCN)2+2H2O
|
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
8.下列关于元素的叙述正确的是 ( )
A.金属元素非金属元素能形成共价键化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
7.F2是氧化性最强的非金属单质。在加热条件下,物质的量相等的F2(g)跟烧碱完全反应,生成NaF、H2O和另一种气体,该气体是下列中的 ( )
A.H2 B.HF C.OF2 D.O2
6.关于Na元素和F元素的叙述正确的是 ( )
A.原子序数Na>F B.原子半径Na<F
C.原子的电子层数Na<F D.原子最外层电子数Na>F
5.下列说法正确的是 ( )
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物质酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
4.用盐酸制取等量的Cl2,被氧化的HCl的量最少的是 ( )
A.KClO3+6HCl KCl+3Cl2↑+H2O
B.Ca(ClO)2+4HCl CaCl2+2Cl2↑+2H2O
C.MnO2+4HCl MnCl2+Cl2↑+2H2O
D.2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O
3.下列说法正确的是 ( )
A.用乙醇或CCl4可提取碳水中的碳单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.24Mg32S晶体中电子总数与中子总数之比为1:1
D.H2S和SiF4分子中各原子最外层都满足8电子结构
2.最近医学界通过用放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关14C的叙述正确的是( )
A.与C60中普通碳原子的化学性质不同
B.与14N含的中子数相同
C.是C60的同素异形体
D.与12C互为同位素
1.A、B两种元素可形成AB2共价型化合物,它们的原子序数是 ( )
A.3和9 B.6和8 C.10和14 D.17和12
29.(15分)如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:
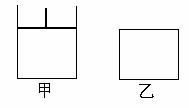
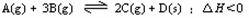
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是
A.混合气体的总质量不随时间改变; B.2v正(C)=3v逆(B);
C.A、B转化率相等; D.物质D的质量不随时间改变;
(2)2min后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时容器的体积为 mL,B的转化率α甲(B)为 .
(3)乙容器中反应达到平衡所需要的时间 2min(填“>”、“<”或“=”,下同=,B的转化率α乙(B) α甲(B)
(4)其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C) mol,加入D的物质的量n (D)应该满足的条件为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com