
8.下列各组物质在溶液中的反应,可以用同一离子方程式表示的是 ( )
A.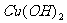 和盐酸,
和盐酸,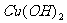 和醋酸
和醋酸
B.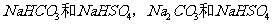
C.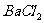 和
和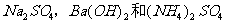
D.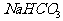 (过量)和
(过量)和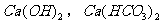 和
和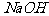 (过量)
(过量)
7.下列各组溶液中所含溶质的物质的量相等,将其充分混合后不会产生沉淀的是 ( )
A.CaCl2、NaHCO3、KOH B.MgCl2、Ba(OH)2、HCl
C.FeCl3、H2S、HCl D.NaAlO2、K2CO3、NH3·H2O
6.现有碳酸钠、氢氧化钡、硫酸三种体积和物质的量浓度都相同的溶液,以不同的顺序将它们混合,如生成沉淀,立即过滤掉。关于所得溶液的酸碱性的下列结论中不正确的是
( )
A.一定显碱性 B.可能显中性 C.不可能显酸性 D.可能显碱性
5.若溶液中由水电离产生的c(OH_)=10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是 ( )
A.Al3+、Na+、NO3-、Cl- B.Na+、K+、NO3-、Cl-
C.Na+、K+、Cl-、AlO2- D.NO3-、K+、NH4+、SO42-
4.下列离子方程式正确的是 ( )
A.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热:OH-+NH4+
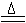 H2O+ NH3↑
H2O+ NH3↑
C.氢氧化镁与稀硫酸反应:H++ OH-= H2O
D.单质铜与稀硝酸反应:Cu+2H++2NO3-= Cu2++2NO↑+ H2O
3.将n molCu2S的与足量的稀硝酸反应,生成硝酸铜、硫酸、一氧化氮和水,则参加反应的硝酸中被还原的硝酸的物质的量是 ( )
A.4n mol B.10n mol C.10n/3 mol D.2n/3 mol
2.Na2O2、CaC2、CaH2、Mg3N2都能与水反应,且反应中都有气体放出。下列说法正确的是 ( )
A.都是氧化还原反应 B.CaC2, Mg3N2与水反应属于复分解反应
C.Na2O2,CaH2与水反应,水作氧化剂 D.CaH2与水反应产生H2,它是氧化产物
1.下列物质:1Cl22Na 3Na2O2 4NO2分别与水反应,氧化剂与还原剂的物质的量之比为1:1的是 ( )
A.12 B.23 C.123 D.1234
22.(6分)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L 的NaOH溶液(密度1.12.g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0600mol。
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2): n(H2)= 。
21.(8分)以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:
硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平、酒精灯
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是 ;
(2)指出实验步骤中存在的错误并改正:
;
(3)硫酸钠不能放置在空气中冷却的原因是:
;
(4)步骤⑤的目的是 ;
(5)下面的情况有可能造成测试结果偏高的是 (填序号)。
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时有晶体溅出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com