
7.在硫酸铁溶液中,加入a g铜,完全溶解后,再加入b g 铁,充分反应后得到c g残余固体,且a>c。则下列说法正确的是( )
A.残余固体全是铜 B.残余固体可能为铁和铜的混合物
C.溶液中一定不含Cu2+ D.最后所得的溶液可能含有Fe3+
6.铀的常见化合价有+4价和+6价。硝酸铀酰[UO2(NO3)2]加热到600℃时可发生如下分解反应:UO2(NO3)2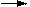 UxOy+NO2↑+O2↑(没有配平)。将气体收集于试管中并倒扣水中,水充满试管。则生成的UxOy化学式是( )
UxOy+NO2↑+O2↑(没有配平)。将气体收集于试管中并倒扣水中,水充满试管。则生成的UxOy化学式是( )
A. UO2 B. UO3 C. 2UO2 ·UO3 D. UO2 ·2UO3
5.三聚氰酸[C3N3(OH)3]加热至一定温度时,它发生如下分解反应产生异氰酸HNCO(H-N=C=O),可用于消除汽车尾气中的NO2。其反应原理为: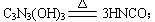
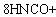
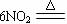 7N2+8CO2+4H2O。异氰酸与氰酸(H-O-C≡N)在结构上有点不同。下列说法不正确的是( )
7N2+8CO2+4H2O。异氰酸与氰酸(H-O-C≡N)在结构上有点不同。下列说法不正确的是( )
A.异氰酸与氰酸互为同分异构体 B.异氰酸(HNCO)中碳元素为+4价
C.HNCO是一种很强的氧化剂 D.消除尾气的反应中氧化产物与还原产物之比4∶3
4.某固体物质和某浓酸在玻璃器皿中加热条件下反应,产生气体的相对分子质量或平均相对分子质量为28,则参加反应的两物质是( )
A. Zn和浓H2SO4 B. C和浓HNO3 C. MnO2和浓盐酸 D. C和浓H2SO4
3.下列离子方程式正确的是( )
A.用饱和碳酸钠溶液吸收少量SO2:2CO32-+SO2+H2O == 2HCO3-+SO32-
B.向NH4HCO3溶液中加少量NaOH:NH4+ +OH-== NH3·H2O
C.向AgNO3溶液中加入过量氨水:Ag+ + 3NH3·H2O ==[Ag(NH3)2]++NH4+ +OH-+2H2O
D.向Ca(HCO3)2溶液加入过量Ca(OH)2溶液:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
2.用NA代表阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4LHF所含的分子数为1NA
B.标准状况下,22.4LCl2溶于足量的水中且与水反应转移电子数为1NA
C.14g乙烯和丙烯的混合物中原子总数为2NA
D.32g O2参加化学反应时转移电子数为1NA或2NA或4NA
1.将20gBa(OH)2·8H2O粉末和10gNH4Cl晶体放入烧环中,用玻璃棒搅拌,使两者接触反应,对该反应的叙述错误的是( )
A.复分解反应 B.非氧化还原反应 C离子反应. D.吸热反应
29.(8分)将32 g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
(1)NO的体积为 L,NO2的体积为 L,
(2)待产生的气体全部释放后,向溶液中加入VmL amol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要双氧水的物质的量为 mol。
28.(12分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
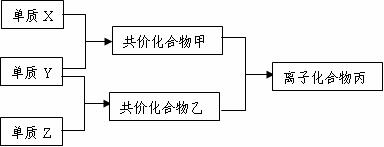
已知: a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
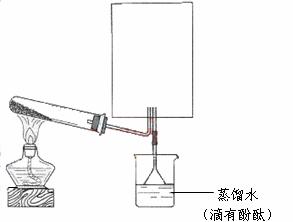
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是 。
27.(8分)下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一,C、D、E、F都是单质。
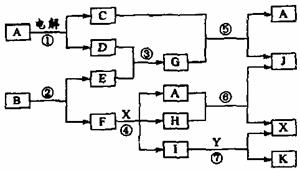
请按要求填空:
(1)写出下列物质的化学式:A: ,E: F: ,Y: 。
(2)反应③的化学方程式为: 。
(3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com