
6.某消毒液无色,用红色石蕊试纸检验,发现试纸先变蓝后褪色,则该消毒液的主要成分可能是 ( )
A.KMnO4 B.NaClO C.H2O2 D.Cl2
5.通过化学反应不能实现的是 ( )
A.生成一种新离子 B.生成一种新分子
C.生成一种新核素 D.生成一种新单质
4.下列各组微粒中,核外电子总数相等的是 ( )
A.Na+和Li+ B.CO和CO2
C.H2O 和Al3+ D.NO和CO
3.下列物质按不同类别分组,所得组合最不合理的是 ( )
(1)糖类(2)塑料(3)石油(4)蛋白质(5)合成纤维(6)棉花(7)陶瓷(8)玻璃(9)天然气(10)水泥(11)合成橡胶(12)煤(13)油脂(14)羊毛
A.(1)(4)(13) B.(2)(5)(11) C.(7)(8)(11)(14) D.(3)(9)(12)
2.张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。这是相对原子质量表中首次采用我国测定的相对原子质量值。则下列关于In的说法中,错误的是 ( )
A.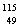 In原子核外有49个电子
In原子核外有49个电子
B.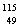 In原子核内有49个中子
In原子核内有49个中子
C.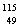 In原子核内质子数和中子数之和等于其质量数,为115
In原子核内质子数和中子数之和等于其质量数,为115
D.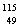 In是In元素的一种核素
In是In元素的一种核素
1.2004年2月22日是第35个“世界地球日”,我国确定的主题是“善待地球--科学发展”,下列行为中不符合这一主题的是 ( )
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.大量开采地下水,以满足社会对水的需求
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D.节约能源,提高能源利用率
21.(13分)某化学兴趣小组的同学为探究无水草酸受热分解的产物并通过实验验证分解的产物的性质,查阅了大量资料,获得了草酸的一些信息,整理出下表:
|
(1) 草酸晶体 |
分子式 |
H2C2O4·2H2O |
颜色 |
无色晶体 |
|
熔点 |
100.1℃ |
受热至100.1℃时失去结晶水,成为无水草酸。 |
||
|
(2) 无水草酸 |
结构简式 |
HOOC-COOH |
溶解性 |
能溶于水或乙醇 |
|
特性 |
大约在157℃升华(175℃以上发生分解)。 |
|||
|
化学性质 |
H2C2O4 +
Ba(OH)2 == BaC2O4↓+ 2H2O |
|||
HOOC-COOH 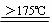 CO2↑+CO↑+H2O↑ CO2↑+CO↑+H2O↑ |
A有同学认为用下图装置进行实验,装置过于简约,在实验的科学性、可行性和安全性都存在不妥之处,请从上述三方面指出不合理之处和原因
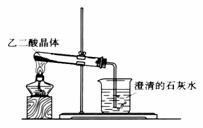
⑴ ;
⑵ ;
⑶ 。
B该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物,以确定FexOy的组成。
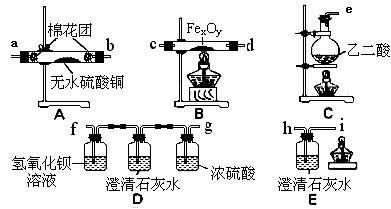
⑷实验所需的仪器装置如上图所示,各装置的连接顺序为:
e接 、 接 、 接 、 接 h 。
⑸该组同学进行了下列实验操作:
① 点燃B处的酒精灯;② 检查实验装置的气密性并装入药品;
③ 反应结束后,先熄灭B处的酒精灯,继续通入气体直到B中固体全部冷却后,再熄灭c处的酒精灯;④ 点燃c处的酒精灯,开始反应,在装置E的i口处收集一试管气体,验纯;
⑤ 点燃尖嘴i处的酒精灯。正确的实验操作顺序是: 。
⑹收集气体验纯的目的是 。
⑺反应完全后,该组同学进行数据处理。反应前样品FexOy的质量为32 g,反应后,装置E中澄清石灰水中产生60g沉淀物。则样品FexOy的化学式( )。
A. FeO B. Fe2O3 C. Fe3O4 D. Fe5O7
⑻能验证CO氧化产物的现象是 ,本实验有没有不妥之处?如果有,请答出改进的方案;若无,此问可不必答。 。
20.(10分)二氧化锰是制造锌锰电池的基本材料。废旧锌锰干电池经回收处理得到粗锰粉(含MnO2、Mn(OH)2、Fe和炭黑),工业上以粗锰粉为原料制备高纯二氧化锰的流程如下:
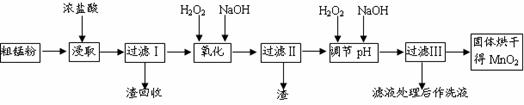
部分阳离子以氢氧化物沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
沉淀开始 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Mn(OH)2 |
8.3 |
9.8 |
⑴锌锰干电池是以糊状NH4Cl作电解质溶液,电池总反应式
Zn + 2NH4Cl+2MnO2 == ZnCl2 + 2NH3 + Mn2O3 +H2O, 则正极的电极反应式为: 。
碱性锌锰电池是以KOH作电解质溶液,电池总反应式为:
Zn + 2MnO2 + H2O == Zn (OH)2 + Mn2O3,则正极的电极反应式为: 。
⑵在加热条件下,用浓盐酸浸取粗锰粉,所得溶液含Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程式 。
⑶过滤Ⅰ除去不溶性杂质后,向滤液加入足量的H2O2溶液,其作用是 。
⑷过滤Ⅰ所得溶液氧化后,需加入NaOH溶液调节pH值约为5.4,其目的是 。
⑸过滤Ⅱ所得溶液加入足量的H2O2溶液并加入NaOH溶液调节pH值约为8.2,使Mn2+氧化得到MnO2,该反应的离子方程式为 。
19.(6分)甲、乙、丙、丁和戊五种溶液分别由NH4+、K+、Ag+、Al3+、Ba2+和Cl-、Br-、NO3-、CO32-、SO42-中的一种组成(离子不重复)。其中甲、丙和戊溶液呈酸性,乙溶液呈碱性,甲和乙反应可生成白色沉淀和气体,丁可分别与甲、乙、丙三种溶液生成白色沉淀。据上述现象推断丙、丁和戊溶液中溶质的化学式。丙 ,丁 ,戊 。
18.(6分)有一种溶液A中,可能含Na+、NH4+、Mg2+、Al3+、Fe3+和Cl-、HCO3-、CO32-、SO32-、SO42-中的某些离子。各取10mLA溶液在①、②两支试管中进行实验,其操作及现象如下:
①第一支试管加入HNO3酸化的Ba(NO3)2,只有白色沉淀。
②第二支试管中滴加NaOH溶液至过量并共热,发现开始时产生的白色沉淀后来部分消失,但无气泡产生。⑴A中肯定存在离子是: ,不可能存在离子是: 。
⑵设计实验对不能肯定存在阴离子加以鉴别。说明操作及现象: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com