
30.在实验室中拟用氧化铜、稀硫酸和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案:
甲:①把CuO溶于适量稀硫酸中;②在①的溶液中加入适量Zn,充分反应后过滤、烘干,即得纯净的CuO。
乙:①锌与稀H2SO4反应制H2;②将H2通入CuO中并加热,充分反应后即得纯净的Cu。
回答下列问题:
(1)若要制得相同质量的纯Cu,所消耗的锌和稀硫酸的量是:甲 乙(填“大于”、“小于”或“等于”),原因是 。
(2)丙同学认为上述两种方案所制得的Cu都难以保证Cu的纯度,应对上述两种方案加以完善。你 (填“是”或“否”)赞同丙同学的看法。
理由①(对甲学实验而言) ,
②(对乙同学实验而言) 。
(3)请你分别对甲、乙两同学的实验加以完善:
①
②
29.据2004年1月17日报道,意大利科学家使用普通氧化子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构。
(1)下列有关O4的说法正确的是
A.O4分子内存在极性共价健
B.合成O4的反应可看互核聚变反应,即不属于化学反应
C.O4与O3、O2都是氧的同素异形体
D.O4将来可用作更强有力的火箭推进的氧化剂
(2)制备含O-2、O2-2甚至O+2的化合物都是可能的,通常它们在氧分子进行下列各种反应时生成的:
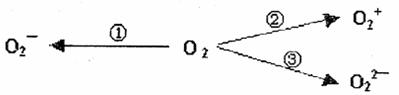
上述反应中, (填序号)相当于氧分子被氧化; (填序号)相当于氧分子被还原。
(3)写出O2-2的电子式:
(4)O2[PtF6]是一种含有O+2的化合物,请写出一种含有O-2的化合物的化学式
28.有A、B、C、D、E、F六种短周期元素,原子序数依次增大,其中A、D元素的原子最外层电子均只有一个电子,且A和D可形成离子化合物;C、F同主族,B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4;F元素原子最外电子层比同周期的E元素原子的最外层多4个电子,请回答:
(1)写出A、D两种元素组成的化合物的电子式 ;
(2)写出B、D、E三种元素组成的常见化合物的名称 ;
(3)工业生产E的方法是 ;
(4)D、F两元素最高价氧化物的水化物之间发生的反应的化学方程式
(5)D的氢氧化物和C的氢化物在水溶液中反应的离子方程式为
27.高炉炼铁的基本反应之一如下:
 FeO(s)+CO(g)
Fe(s)+CO2(g)-Q
FeO(s)+CO(g)
Fe(s)+CO2(g)-Q
该反应达到平衡时,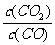 是一个常数(用K表示),已知1100℃时,K=0.263。
是一个常数(用K表示),已知1100℃时,K=0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 ,K值 (填“增大”“减小”或“不变”)
(2)1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,此时该反应是否处于化学平衡状态 ,此时化学反应速度是v正 v逆,其原因是
。
26.①指出在使用下列仪器(已净)或用品的第一步操作:
|
石蕊试纸检验气体 |
容量瓶 |
|
|
|
②下面是中学化学实验常见的几种定量仪器:
A.量筒 B.容量瓶 C.滴定管 D.托盘天平,其中
(填代号)
|
标出仪器使用温度的是 |
标有0刻度,且0刻度在上方的是 |
能够用以精确量取液体体积的是 |
使用A、C时由于俯视读数,使得到的数据比正确数据偏小的是 |
|
|
|
|
|
③利用图所示装置收集以下8种气体。(图中烧瓶的位置不得变化)
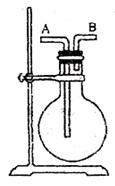
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2
(答案均填序号)
(1)若烧瓶是干燥的,则由B口进气可收集的气体有
(2)若烧瓶是干燥的,则由A口进气可收集的气体有
(3)若烧瓶充满水,可收集的气体有 ;此时气体由 口进入。
(4)若烧瓶内装入浓H2SO4进行气体干燥,则可用此装置干燥的气体有 ,这时气体由 口进入。
25.X、Y是短周期元素,它们可组成化合物XY,则下列说法正确的是 ( )
A.XY晶体一定是离子晶体
B.若Y的原子序数为z,X的原子序数一定是z±6
C.X、Y可属同一周期,也可属于两个不同周期
D.X与Y一定不属于同一主族
24.在容积为672mL的烧瓶里充满NO、NO2的混合气体,将其倒立在水槽里,去塞后再通入280mL氧气,恰好完全反应,且水充满烧瓶(气体体积都折合成标准状况下)。下列有关叙述中,正确的是 ( )
A.总反应为NO+NO2+O2+H2O=2HNO3
B.总反应为4NO+8NO2+5O2+6H2O=12HNO3
C.生成HNO3的物持的量浓度接近0.03mol·L-1
D.生成HNO3的物持的量浓度约为0.045mol·L-1
23.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.80g硝酸铵含有氮原子数为2NA
B.常温常压下,22.4L的D2、H2组成的气体分子数为NA
C.标准状况下,22.4LSO3中含有的氧原子数为0.3NA
D.1molNa2O2与足量CO2反应转移的电子数NA
|
22.下列反应,最终有沉淀生成的是 ( )
A.向石灰水中通入过量的CO2
B.向NaCl饱和溶液中通入氨气及过量的CO2
C.向氯化钙溶液中通入过量的CO2
D.向硅酸钠溶液中通入过量的CO2
20.将Na2O2逐渐加入到含有Al3+、Mg2+、NH+4的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示,则原溶液中Al3+、Mg2+、NH+4的物质的量分别为 ( )
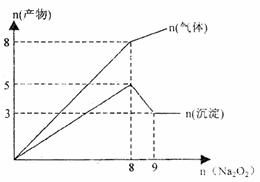
A.2mol、3mol、8mol
B.3mol、2mol、8mol
C.2mol、3mol、4mol
D.3mol、2mol、4mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com