
7.下列实验听任中,错误的是 ( )
A.配 5%配食盐溶液时,将称量的食盐放入烧杯中,加计量的水搅溶解即可
B.硫酸铜晶体结晶水含量测定时,需边加热边搅拦,防止晶体飞溅
C.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D.中和热测定实验中,应用环型玻璃搅拦棒轻轻搅动混合液
6.下列关系中正确的是 ( )
A.原子半径:K>Mg>Na B.热稳定性:HCl>PH3>H2S
C.氧化性:Cu2+>Ca2+>Al3+ D.酸性:HNO3>H3PO4>H3AsO4
32.一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L─1的NaOH溶液(密度为1.12 g·cm─3)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
⑴ 原NaOH溶液溶质的质量分数为 ;
⑵ 所得溶液中Cl─的物质的量为 ;
⑶ 所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2) = ;
⑷ 若标准状况下a L H2和Cl2的混合气体经光照充分反应后,所得气体恰好使溶液中b mol NaOH完全转化为盐,则a、b的关系是 。
31.(6分)某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl4, 振荡后静置,观察到下层液体呈紫红色;②取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。
(1)写出实验②中发生氧化还原反应的离子方程式_____________________________;
(2)由上述两个实验,对物质的氧化性强弱的比较可以得出的结论是(填序号)_______;
A.Br2>I2 B.Fe3+>Br2 C.Br2>Fe3+ D.I─>Br─
(3)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明。①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉液
(提示:请写出实验步骤、现象及结论)___________________________ __
______________________________________________________________________。
30.(13分)为了探究硫化钠晶体(Na2S·nH2O)在空气中的变化,某兴趣小组的实验步骤及现象记录如下:①将少量硫化钠晶体置于表面皿上,暴露在空气中。②三天后将样品放入盛水的烧杯中,搅拌后得到无色澄清溶液。③取少量该溶液加入过量盐酸中,有气体放出,且溶液保持澄清。 ⑴请你根据上述记录猜想实验③中所放出气体的成分可能是(至少写出三种)]
。
⑵若所放出的气体为两种气体的混合气体,请利用以下装置探究混合气体的成分:
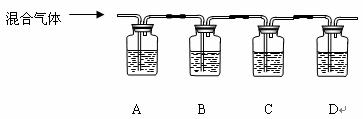
供选试剂为:澄清石灰水、品红溶液、浓溴水(试剂可重复使用)
①指出各瓶的试剂A___________B_____________C____________D____________。
②若A中现象为_______________________,则混合气体为______________________; 若A中现象为____________________,则混合气体为________________________;
③写出以上两种情况下B瓶中反应的化学方程式:____________________________;
_________________________________________________。
④本实验中浓溴水还可用(写名称)___________________________代替。
29.(10分)A、B、C、D为中学化学中常见的四种单质。
(1)已知在空气中A约占21%(为体积分数)、C易溶于CS2但不能在空气中自燃;D
在标准状况下的密度为3.170 g·L─1。分别写出A、C、D的化学式:A 、
C 、D 。工业上制取C的氧化物的反应化学方程式为:
。
(2)在一定条件下B与A、C、D化合分别生成甲、乙、丙。已知乙、丙分子中含有的电子数均与K+相同。乙的化学式是:乙 ;丙的电子式是: 。
(3)C可以发生如下图所示一系列转化(无关物质及反应条件已略)
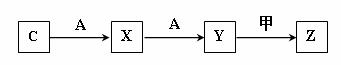
足量的单质A与化合物乙反应的化学方程式 。Z的浓溶液与铜粉在加热的条件下反应,当反应中有1.806×1024个电子转移时,被还原的Z物质的量是 mol。
28.(6分) A、B、C、和D都是周期表中前20号元素,已知:
①A的阳离子D的阴离子具有相同的核外电子排布,且能形成组成为AD的化合物;
②B和D属同族元素,它们能形成两种常见化合物;
③C和B属同一周期元素,它们能形成两种气态化合物:
④C和B、D和B、A和C、C和D都能形成组成为WX2型的化合物;
⑤它们形成WX2型的化合物中有一种是实验室制取某种气体的原料,有一种是有机溶剂。
请回答:
(1)化合物AD和AC2的化学式分别是 和 。
(2)写出实验室以AC2为原料制取气体的化学方式 。
(3)B和D形成的两种常见化合物的分子式是 和 。
(4)写出D和B形成的一种气态化合物跟AB反应的化学方程式:
27.(8分)甲、乙、丙、丁四种单质在点燃条件下反应,可分别生成X、Y、Z、W四种化合物,其转化关系如图所示。已知:①甲、乙、丙为短周期元素的单质,通常状况下为气体;丁是生活中常见金属。②通常状况下,X是无色液体,Y是黑色晶体。③丙在乙中燃烧发出苍白色火焰。
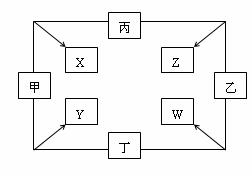
(1)红热的丁和乙反应的现象为 ,过量的丁与W反应的离子方程式为
。
(2)Y与Z的溶液反应的离子方程式为 ,比较Z与乙的氧化性强弱的实验事实为 。
(3)将少量W的饱和溶液滴入沸腾的X中,得到红褐色液体,反应的离子方程式为
。
26.(9分)2006年8月末,甘肃省徽县水阳乡有373名儿童被诊断为重度铅中毒。国家环保总局派出专家调查认为,水阳乡新寺村旁的一家铅锭冶炼厂是“罪魁祸首”, 铅锭冶炼厂周边土地已全部被污染。《东方时空》、《焦点访谈》专门对此做了报道,血铅超标的病人正在接受有效治疗。
(1)铅位于周期表的 周期 族,已知+2价铅比+4价铅稳定,即+4价铅有较强
的氧化性。将PbO2与浓盐酸加热产生黄绿色的气体,写出该反应的离子方程式
,
将SO2通入棕色PbO2的悬浊液会产生白色沉淀,写出该反应的化学方程式
。
(2)铅在自然界主要以方铅矿(PbS)存在,铅锭冶炼厂主要采用火法冶炼铅,其主要过程是先煅烧方铅矿制氧化铅,再用CO还原氧化铅制铅。请写出上述过程有关的化学方程式 , 。
25.(7分)图中的每一方格表示有关的一种反应物或生成物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去)。已知常温下B、C为气态单质,G为固态单质,其余均为化合物。A是由2种短周期元素组成的离子化合物。B形成的氧化物的总电子数比F的总电子数少8。请填写下列空格:
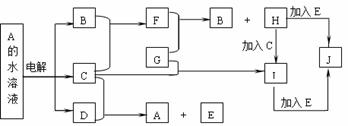
(1)E是_________,I是_________,I溶液蒸干并灼烧,所得固体是 (均填化学式)。
(2)写出C的水溶液与SO2反应的离子方程式
(3)写出I+E-J在水溶液中反应的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com