
7.下列反应中调节反应物用量或浓度,反应产物不会改变的是 ( )
A.碳在氧气中燃烧 B.二氧化硫通入石灰水中
C.硫酸加入锌粉 D.铁在氯气中燃烧
5.在pH=0溶液中,下列各组离子因发生氧化还原反应而不能大量共存的是 ( )
A.Ag+、Ca2+、Cl-、CO32- B.Cl-、SO32-、K+、Na+
C.Fe2+、Na+、K+、NO3- D.K+、Na+、Br-、Cl-
|
A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O) D.4v(O2)=5v(NO)
4.下列实验操作或对实验事实的叙述不正确的是 ( )
A.用酸式滴定管最取20.00mL 0.1mol·L-1 KMnO4溶液
B.用氨水除去Mg2+溶液中的Al3+
C.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
D.用稀HNO3清洗做过银镜反应实验的试管
3.下列事实与胶体性质无关的是 ( )
A.FeCl3溶液用于止血 B.硅胶的电泳现象
C.明矾用于净水 D.药皂里加硫
2.下列化学用语表示错误的是 ( )
A.次氯酸电子式 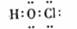 B.氢氧根电子式
B.氢氧根电子式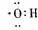
C.镁离子结构示意图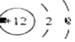 D.硫离子结构示意图
D.硫离子结构示意图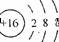
1.某地发生了食用熟牛肉中毒事件,导致四个死亡、一百多人中毒。经过对该牛肉的检测,中某盐的含量比国家标准允许的含量高800多倍,则该盐可能是 ( )
A.NaNO2 B.NaNO3 C.NaCl D.BaSO4
28.(8分)化合物A的结构简式为: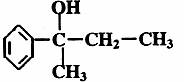
工业上可以最基础的石油产品(乙烯、丙烯、苯等)进行合成。合成A的过程可表示为:
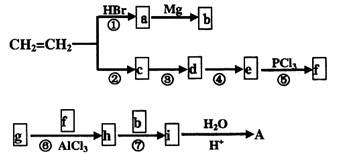
已知:(1)
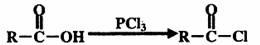
(2)
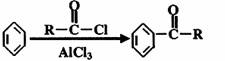
(3)
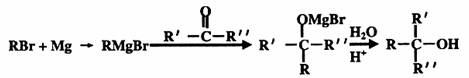
按要求回答下列问题:
(1)写出下列符号所代表物质的结构简式
c: ,h: ;
(2)上述①-⑦的反应中属于取代反应的有 ,属于加成反应的有
;
(3)A与浓硫酸加热得可B和C,其中B分子中所有碳原子处于同一平面上,则生成B 物质的反应方程式为 。
24.(7分)在实验室中做如下实验:将物质A、B按一定比例充入一个表面积为800cm2,容积为2L的球形容器中,压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:2A(g)+B(g) 2C(g);△H=-180kJ·mol-1;
(1)若平均每分钟生成0.5molC,容器表面向外散热速率平均为400J·min-1·cm-2,为了维持恒温t℃,平均每分钟需用加热器提供 kJ的热量。
(2)将2molA与1molB充入上述2L反应容器中,反应过程中A(g)、B(g)、C(g)物质的量变化如下图所示:
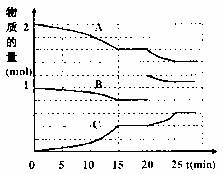
①20min时发生变化的条件是 ;
A.加入催化剂
B.降低温度
C.缩小了容器体积
D.增加了B物质的量
②在15min达到平衡,此时平衡常数K= (用分数表示)。若保持体系温度为t℃,则随着反应的进行,K值 。(填“增大”、“减少”、“不变”)
③若起始时在此2L容器中充入1.2mol A(g)、0.6mol B(g)和0.8mol C(g),维持恒温t℃,达到平衡时C(g)的百分含量较原平衡 (填“增大”、“减少”、“不变”)。
23.(8分)I.(1)已知298K时2C(s)+O2(g)=2CO(g) △H1=-221.01kJ·mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5kJ·mol-1
则298K时CO(g)在O2(g)燃烧生成CO2(g) 的热化学反应方程式为:
;
(2)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。
该电池工作时的负极反应式为: ;
熔融盐中CO32-的物质的量在工作时 (填“增大”、“减少”、“不变”)。
II.如下图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液见图。
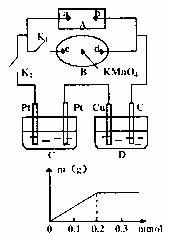
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源a端为 极,通电一段时间后,观察到滤纸d端出现的现象是: ;
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示。则Cu2+、X3+、H+氧化能力由大到小的顺序是 ;D装置Cu极的电极反应式为 。
22.(8分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应条件及生成的水已略去),已知:A、B、C、D为四种非金属单质,其中B、C、D在常温常压下是气体;反应①②是化工生产中的重要反应;化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥,化合物L具有漂白性,可由Cl2与NaOH反应而制得,J由两种元素组成,其相对分子质量为32。按要求填空:
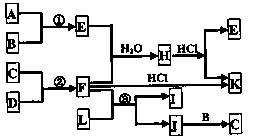
(1)A元素在周期表中的位置是: ;
(2)J的化学式 ;
(3)写出L溶液与化合物E反应的离子方程式:
;
(4)将F水溶液与盐酸混合得到一种无色透明溶液,在此溶液中只含有四种离子,按四种离子浓度从大到小顺序把它们可能的一种关系表示出来。
|
|
溶液酸碱性 |
离子浓度大小顺序 |
|
1 |
酸性 |
|
|
2 |
中性 |
|
|
3 |
碱性 |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com