
9.下列叙述中正确的是
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18个元素
C.副族元素中没有非金属元素
D.碱金属元素是指IA族的所有元素
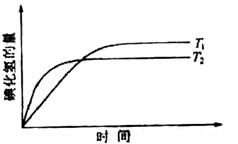
8.在密闭容器中进行如下反应: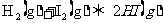 ,在温度T1和T2时,产物的量与反应时间的关系如下图所示。符合图示的正确判断是
,在温度T1和T2时,产物的量与反应时间的关系如下图所示。符合图示的正确判断是
A.T1>T2, >0 B.T1>T2,
>0 B.T1>T2, <0
<0
C. T1<T2,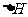 >0 D.
T1<T2,
>0 D.
T1<T2,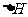 <0
<0
7.下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中合热 H= -57.3 kJ/mol, 则H2SO4和Ca(OH)2反应的中和热
H= -57.3 kJ/mol, 则H2SO4和Ca(OH)2反应的中和热 H=2×(-57.3) kJ/mol
H=2×(-57.3) kJ/mol
B. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的 H=2×283.0 kJ/mol
H=2×283.0 kJ/mol
C.需要加热才能发生的反应一定是加热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
6.下列说法中不正确的是
A.1 mol氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L
B.1 mol臭氧中和1.5氧气含有相同的氧原子
C.等体积、浓度均为1 mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
D.等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3
29.(16分)
(注意:在试题卷上作答无效)
A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
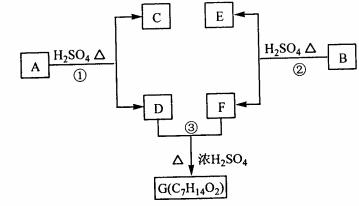
(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显紫色,C与溴水反应生成的一溴代物只有两种,则C的结构简式为 ;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为 ,D具有的官能团是 ;
(3)反应①的化学方程式是 ;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是 ;
(5)E可能的结构简式是
。
28.(13分)
取化学式为MZ的黄色粉末状化合物进行如下实验。将MZ和足量碳粉充分混合,平铺在反应管a中。在b瓶中盛足量澄清石灰水。按图连接仪器。
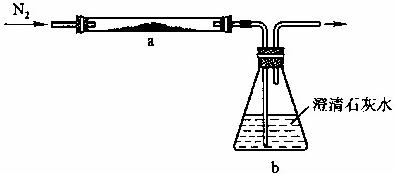
实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。此时,管中的熔融物凝固成银白色金属。根据以上叙述回答问题:
(1)元素Z是 ;
(2)停止加热前是否需要先断开a和b的连接处?为什么?
(3)反应管a中发生的所有反应的化学方程式是
(4)本实验的尾气是否需处理?如需处理,请回答如何处理;如不需处理,请说明理由。
27.(15分)
(注意:在试题卷上作答无效)
V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成。上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
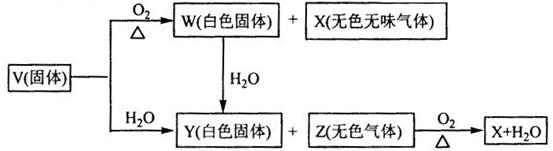
(1)5种化合物分别是V 、W 、X 、Y 、Z (填化学式)
(2)由上述5种化合物中的某2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 ;
(3)V的电子式是
26.(16分)
(注意:在试题卷上作答无效)
实验室可有软锰矿(主要成分为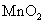 )制备
)制备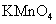 ,方法如下:软锰矿与过量固体
,方法如下:软锰矿与过量固体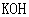 和
和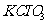 在高温下反应,生成锰酸钾(
在高温下反应,生成锰酸钾(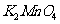 )和
)和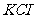 ;用水溶解,滤去残渣,滤液酸化后,
;用水溶解,滤去残渣,滤液酸化后,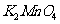 转变为
转变为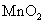 和
和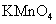 ;滤去
;滤去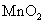 沉淀,浓缩滤液,结晶得到深紫色的针状
沉淀,浓缩滤液,结晶得到深紫色的针状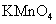 。请回答:
。请回答:
(1)软锰矿制备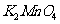 的化学方程式是
;
的化学方程式是
;
(2)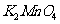 制备
制备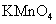 的离子方程式是
;
的离子方程式是
;
(3)若用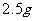 软锰矿(含
软锰矿(含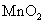 80%)进行上述试验,计算
80%)进行上述试验,计算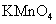 的理论产量;
的理论产量;
(4)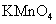 能与热的经硫酸化的
能与热的经硫酸化的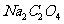 反应生成
反应生成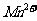 和
和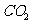 ,该反应的化学方程式是
;
,该反应的化学方程式是
;
(5)上述制得的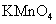 产品
产品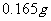 ,恰好与
,恰好与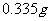 纯
纯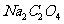 反应完全。计算该
反应完全。计算该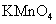 的纯度。
的纯度。
13.电解100mL含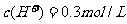 的下列溶液,当电路中通过
的下列溶液,当电路中通过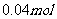 电子时,理论上析出金属质量最大的是
电子时,理论上析出金属质量最大的是
A.0.10mol∕LAg+
B.0.20mol∕LZn2+
C.0.20mol∕LCu2+
D.0.20mol∕LPb2+
第Ⅱ卷
12.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为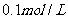 的NaA和NaB混合溶液中,下列排序正确的是
的NaA和NaB混合溶液中,下列排序正确的是
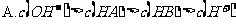
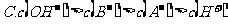
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com