
20.(9分) 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g);△H < 0
2SO3(g);△H < 0
(1)一定体积的密闭容器中判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.SO2百分含量保持不变
e.SO3的生成速率与SO2的消耗速率相等
(2)降低温度,二氧化硫转化率 ,化学反应速率 (以上均填“增大”、“减小”或 “不变”)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
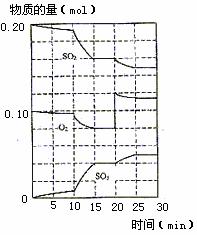
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是 (用文字表达),10 min 到15 min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容积体积
c.降低温度 d.增加SO3的物质的量
19.(7分)如图所示其中A、G是固体单质,其余是化合物。X是常用于切割和焊接金属的可燃性气体,Y是一种难溶于水的白色固体,它的式量是100。请填空:
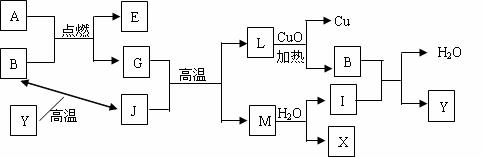
(1)B的结构式为 ,M的电子式为 。
(2)A跟B反应的化学方程式是 。该反应的反应热△H_____0(填“<、=、>”)。
(3)在高温条件下,G跟J反应的化学方程式是 。
(4)上图中,置换反应共有_______个。
(5)1g X完全燃烧生成B和H2O(l)放热Q kJ的热量试写出该反应的热化学方程式:
______________________________________________________________。
18.(8分)现有A、B、C、D、E、F六种化合物,已知它们的阳离子有:
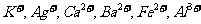 ,
, 阴离子有
阴离子有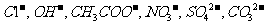 ,现将它们分别配成
,现将它们分别配成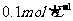 的溶液,进行如下实验:
的溶液,进行如下实验:
(1)测得溶液A、C、E呈碱性,且碱性为A>E>C;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向D溶液中滴加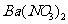 溶液,无明显现象;
溶液,无明显现象;
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
实验②中反应的化学方程式是:_________________________________________;
____________________________________________。
(2)E溶液是 ,判断依据是:__________________________________________;
____________________________________________。
(3)写出下列四种化合物的化学式:A 、C 、D 、.
(4)采用石墨为电极电解A溶液其阳极电极反应为:___________________________。
17.(4分)铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列A、B、C、D中哪个反应:(填写序号,下同)
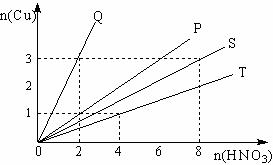
A、铜和浓硝酸B、铜和稀硝酸C、铜和被还原的浓硝酸D、铜和被还原的稀硝酸
(1)Q表示反应 ; (2)P表示反应 ;
(3)S表示反应 ; (4)T表示反应 。
16.已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法正确的是 ( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
15.温度相同、浓度均为0.2mol/L的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、
⑤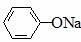 、⑥CH3COONa溶液的pH由小到大的顺序是 ( )
、⑥CH3COONa溶液的pH由小到大的顺序是 ( )
A.③①④②⑥⑤ B.①③⑥④②⑤
C.③②①⑥④⑤ D.⑤⑥②④①③
14.某晶体由两种阳离子、一种阴离子和结晶水组成,取少量该晶体进行如下实验:
①将晶体置于试管中加热,试管口有无色液体生成;
②待试管冷却后加水,固体全部溶解;
③向试管中逐滴加入Ba(OH)2溶液至过量,同时加热,生成沉淀的量先增多后减少,最终仍有沉淀未溶解,此过程中有刺激性气味气体生成。
根据以上实验现象判断,该晶体是 ( )
A.NH4Al(SO4)2·12H2O B.KAl(SO4)2·12H2O
C.(NH4)2Fe(SO4)2·6H2O D.KCl·MgCl2·6H2O
13.下列溶液中可能大量存在的离子组是( )
①使石蕊变红的溶液中Fe3+、NO3-、Na+、SO42-、Cl-
②pH=7的溶液中:Na+、Al3+、Cl-、HCO3-、SO42-
③使石蕊试液变蓝又褪色的溶液中:Ca2+、NO3-、ClO-、Cl-、K+
④常温下,由水电离产生的c(H+)=10-12mol/L的溶液中:Na+、Cl-、CO32-、SO42-
⑤某含SO42-的溶液中:Na+、Ba2+、Cl-、OH- 、NO3-
⑥某含Fe3+的溶液中:NH4+、Cl-、NO3-、SCN-、K+
A.①②③ B.②④⑤ C.⑤⑥ D.①③④
12.在一定条件下密闭容器中发生4NH3(g) + 5O2(g)  4NO (g)+ 6H2O(g)
4NO (g)+ 6H2O(g)
ΔH=akJ/mol反应过程中能量变化如图所示下列说法正确的是 ( )
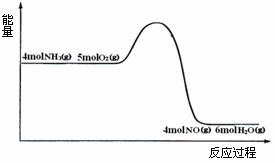
A.由图可知a>0
B.升高温度可以提高NH3的转化率
C.反应体系中加入催化剂可增加反应热
D.将平衡混合物通入水中一定有硝酸铵生成
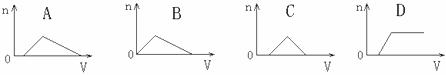
11.将足量NH3通入HNO3和AgNO3的混合稀溶液中,生成沉淀的物质的量(n)和通入NH3的体积(V)的关系正确的是 ( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com