
依据反应方程式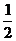 CaCO3+HNO3=
CaCO3+HNO3=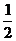 Ca(NO3)2+
Ca(NO3)2+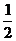 CO2↑+
CO2↑+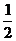 H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
(3)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。
2.00
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响;
(Ⅱ)实验①和 探究温度对该反应速率的影响;
(Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响;)
②
③
④
(2)实验①中CO2质量随时间变化的关系见下图:
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol?L-1、2.00 mol?L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号
T/K
大理石规格
HNO3浓度/mol?L-1
实验目的
①
298
粗颗粒
20.(11分)
Na2CO3?10H2O(s)=Na2CO3?H2O(s)+9H2O(g) ΔH1=+473.63 kJ?mol-1
写出Na2CO3?H2O脱水反应的热化学方程式 。
Na2CO3?10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ?mol-1
 回答下列问题:
回答下列问题:
(1)滤渣的主要成分为 。
(2)“趁热过滤”的原因是 。
(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是 。
(5)已知:
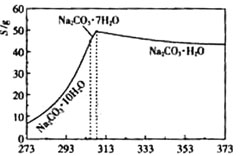
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
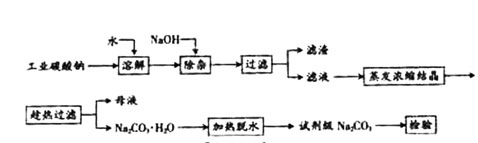
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO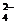 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com