
2、分得开
例二:
(1)读书可以增长知识,充实头脑,一乐;
(2)读书是一种高雅的精神活动,二乐;
(3)读书可以提高素养,陶冶情操,三乐。
24. (13分) 医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
 ___H+ + ___MnO4- + ___H2C2O4 → ___CO2↑+___Mn2+ +____ ;
___H+ + ___MnO4- + ___H2C2O4 → ___CO2↑+___Mn2+ +____ ;
(1)  配平以上离子方程式,并在 中填上所需的微粒。
配平以上离子方程式,并在 中填上所需的微粒。
(2) 该反应中的还原剂是 。
(3) 反应转移了0.4mol电子,则消耗KMnO4的物质的量为 mol。
(4) 测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是 。
②溶解沉淀时 (能或不能)用稀盐酸,原因是 。
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙 g。

 西南师大附中高2010级第一次月考
西南师大附中高2010级第一次月考
23. (18分) 测定样品中成分含量的实验一般应重复二至三次。为了测定某NaOH固体中混有的Na2CO3的质量分数,某同学分别设计了三种实验方案:
I.吸收法
如右图所示:(1) 根据实验装置图分析,在每次实验过程中所进行的称量操作至少要进行_______次,且第一次称量操作的对象是 。
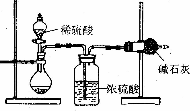 (2) 若重复测定了三次,得到Na2CO3的质量分数的数据存在较大的偏差,产生偏差的原因可能是
(填序号)。
(2) 若重复测定了三次,得到Na2CO3的质量分数的数据存在较大的偏差,产生偏差的原因可能是
(填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.用了稀硫酸与样品反应
C.加入稀硫酸的量不足,则可能造成误差
D.反应完成后,装置中仍存有二氧化碳,没有被碱石灰吸收
除上述原因外,从装置看还有一个重要原因是 。
II.滴定法
称取样品m g,配制成500mL溶液。从中取出25mL加入足量的BaCl2溶液振荡,滴加2-3滴酚酞,用a mol/L标准盐酸滴定,至终点时消耗盐酸v mL。
(1) 该同学加入足量的BaCl2溶液后未将BaCO3过滤就滴定,有人认为在滴定中BaCO3会转化为Ba(HCO3)2,消耗盐酸。你认为要过滤吗? (填“是”或“否”),理由是:
(若填“是”,不需答)。
(2) 判断滴定终点到达的依据是 。
Ⅲ.沉淀法
称取样品m g,并溶解加过量Ba(NO3)2溶液,过滤、洗涤、烘干,称量得固体n g。
(1) 混合物中碳酸钠的质量分数为(用m、n表示) 。
(2) 洗涤沉淀的操作要点是 。
(3) Ca2+、Ba2+都可以使CO32-沉淀完全,但使用Ba(NO3)2溶液而不用Ca(NO3)2溶液的原因是 ;测定CO32-的量,若使用Ba(OH)2溶液而不用Ca(OH)2溶液,结果将具有更高的精确度,原因 。
22. (14分) 铝、铁是重要的金属,在工业生产中用途广泛。
(14分) 铝、铁是重要的金属,在工业生产中用途广泛。
(1) 铝与氧化铁发生铝热反应的化学方程式为 。
(2) 在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化学腐蚀而生锈。其中正极的电极反应为 。
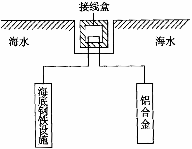
(3) 在海洋工程上,通常用铝合金(Al-Zn-Cd)
保护海底钢铁设施,其原理如图所示,其中负极发生的电极反应为: 。
在实际应用中,用铝合金而不选用纯铝。纯铝不能很好地起到保护作用,其原因是:_________________
。
(4) 碳、铝均能还原铁的氧化物。为确定混合物(FeO、Fe2O3)的组成,进行如下实验:
①取一定量混合物与足量碳粉加热,只收集到CO气体m mol;
②取与①相同量的混合物与足量铝进行铝热反应,得到单质铁n mol;
试计算:混合物中FeO的物质的量分数是 ;
②中铝的物质的量至少是 mol。
21. (18分) 已知M、E为常见金属,根据下列框图回答问题:
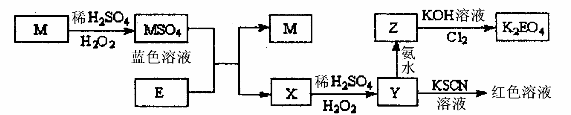
(1) 写出M溶于稀H2SO4和H2O2混合液的离子方程式:
______________________________________________________________________。
(2) 检验X中阳离子的方法和现象是____________________________________________
_________________________________________________________________________________________________________________________________________________。
(3) 写出Cl2将Z氧化为K2EO4的化学方程式:
________________________________________________________________________。
(4) 如下图装置中,b电极用金属M制成,d电极用金属E制成,a、c为石墨电极,接通电源,金属M沉积于b极。
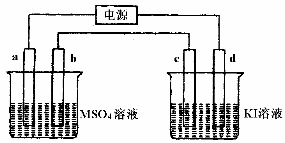
①a为________极,C极的电极反应式为:___________________________________。
②当d极上产生448 mL(标准状况)气体时停止电解,此时b极上析出金属M______g。
③若反应一段时间后,反接电源,此时,d电极的电极反应式为:________________。
20. (8分) (1) 1183K以下纯铁晶体的基本结构单元如图一所示,1183K以上转变为图二所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。
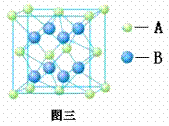
①在1183K以下的纯铁晶体(图一)中,一个结构单元实际占有 个铁原子;
在1183K以上的纯铁晶体(图二)中,与铁原子等距离且最近的铁原子数为 个。
②纯铁晶体在晶型转变前后,两者基本结构单元的边长之比为 ;两种纯铁晶体密度之比为 。(1183K以下与1183K以上之比)
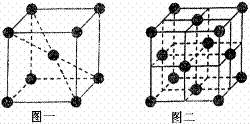
(2) 图三为某晶体的晶胞结构,已知每个B位于周围紧邻的4个A原子构成的正四面体的中心,则每个A周围最邻近的B有_____个,在该晶体的化学式为____________。
19. (7分) A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。其中A、E同主族,B、F同主族,A、F原子最外层电子数之比为1∶4 ,A和D能形成A2D2和A2 D两种化合物。
(1) 写出元素符号E ,BD2的电子式为 。
(2) F与D形成的化合物属于 晶体。
(3) 化合物A2D2是 分子(填极性、非极性)。
(4) A和C的单质可化合生成甲。已知生成1mol甲时,放出的热量为46.1kJ。写出该反应的热化学方程式 。
18. 在蒸馏水中,加入等物质的量的KCl、NaCl、CuSO4、Fe(NO3)3形成混合溶液,用石墨电极电解一段时间后,两极均产生气泡,则下列说法正确的是( )
A.阳极一直产生无色无味气体

B.电解开始时,阴极有金属析出
C.当阴极开始析出金属时,阳极产生无色无味气体
D.当两极均产生气体时,阴极反应式为:2H++2e-=H2↑
西南师大附中高2010级第一次月考
化 学 试 题
第Ⅱ卷(非选择题 共78分)
17. 下列实验对应的结论不正确的是( )
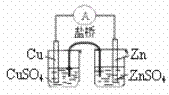
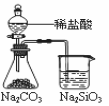




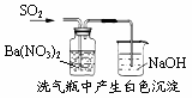
A.能证明非金属性Cl>C>Si B.能组成Zn、Cu原电池 
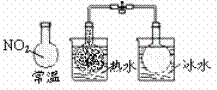




C.说明反应2NO2 N2O4;△H<0
D.白色沉淀为BaSO4
N2O4;△H<0
D.白色沉淀为BaSO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com