
1.使试卷有较大的知识点覆盖面
21、(10分)
将多少克钠投入10g水中,反应后生成的溶液在10°C时刚好饱和?此饱和溶液中溶质的质量分数是多少?(已知10°C时该溶液中溶质的溶解度为22g)
20、(14分)
(1)已知在一定条件下可以发生下列反应:H2O2+2Fe2++2H+?2Fe3++2H2O
H2O2+2Fe3+?2Fe2++O2↑+2H+
在以上反应中Fe2+实际上起着 作用,
总反应式为 。
(2)I2也与Fe2+一样能发生上述类似反应,类比(1)在下面填入配平的合适的化学反应方程式:
H2O2+I2?2HIO, ,总反应式为 。
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H2O2+2I-?I2+O2↑+2H+,这个方程式正确吗? ,理由是 。
(4)若将H2O2滴入酸性高锰酸钾溶液中,产生无色气体,同时溶液的紫色变浅,无沉淀生成,写出反应的离子方程式 。
19、(12分)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)?CO2(g); △H ?E1
途径II:先制水煤气:C(s)+H2O(g)?CO(g)+H2(g); △H ?E2
再燃烧水煤气:H2(g)+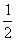 O2(g)?H2O(g); △H ?E3
O2(g)?H2O(g); △H ?E3
CO(g)+ 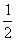 O2(g)?CO2(g); △H ?E4
O2(g)?CO2(g); △H ?E4
试回答:
(1)等质量的煤分别通过以上两条不同途径产生的可利用的总能量的关系正确的是 。
A、I比II多 B、I比II少 C、I与II在理论上相同
(2)E1、E2、E3、E4之间的关系为 。
(3)由于制取水煤气反应里,反应物所具有的总能量 (填“高于”或“低于”)生成物所具有的总能量,所以在化学反应时,反应物就需要 (填“吸收”或“释放”)能量才能转化为生成物,因此该反应的条件为 。
(4)与途径I相比,途径II的优点是
18、已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见化合物。Y的摩尔质量数值比Z的小16,乙、丙的摩尔质量相同,B的摩尔质量比D的小2,B、X的摩尔质量相同。各物质转化关系如下:
(1)写出丙的化学式 ;B的电子式 。
(2)写出Y-Z的化学方程式: 。
(3)实验室贮存Y溶液时易变质,请写出检验Y溶液是否变质所需试剂是 。
17、在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
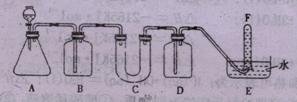
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:
(2)
|
仪 器 |
加入试剂 |
加入该试剂的目的 |
|
B |
饱和NaHCO3溶液 |
|
|
C |
|
|
|
D |
|
|
(3)写出过氧化钠与二氧化碳反应的化学方程式:
(4)试管F中收集满气体后,下一步的实验操作是
16、下列说法正确的是…………………………………………………( )
A、碱金属都很活泼,其单质都应保存在煤油中
B、金属锂不能保存在煤油中,可用液体石蜡保存
C、白磷应保存在CS2中
D、NaOH不能保存在玻璃瓶中
15、钡和钠相似,也能形成含O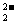 的过氧化物,下列叙述中正确的是………( )
的过氧化物,下列叙述中正确的是………( )
A、过氧化钡的化学式为Ba2O2 B、O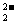 的电子式为:[
的电子式为:[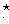
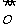 ∶
∶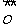
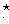 ]2-
]2-
C、反应Na2O2+2HCl?2NaCl+H2O2为氧化还原反应
D、过氧化钡和过氧化钠都具有强氧化性
14、铷是一种碱金属元素,对于铷及其化合物性质的推断正确的是……………( )
①铷的熔点比钾的高 ②氯化铷的水溶液PH=7 ③RbOH的碱性比NaOH强
④铷没有共价化合物 ⑤铷不能从FeCl3溶液中置换出铁
A、②③④ B、①②③④ C、②③④⑤ D、①②③④⑤
13、将含有O2和CH4的混合气体置于盛有23.4g Na2O2的密闭容器中,连续进行电火花点燃,反应结束后,容器内的压强为零(150°C),将残留物溶于水中,无气体产生。原混合气体中O2与CH4的物质的量之比为…………………………………………( )
A、1:1 B、1:2 C、1:3 D、2:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com