
(二) 自然环境中的物质运动和能量交换 1、地壳物质循环 ◆三大类岩石的形成过程和特点
(2007江苏高考)图3 为我国江南园林小景。读图回答5 一6 题。
 5.图中的太湖石是由石灰岩组成,其玲珑剔透独特形态的形成原因是A.风力侵蚀作用 B.岩浆作用
5.图中的太湖石是由石灰岩组成,其玲珑剔透独特形态的形成原因是A.风力侵蚀作用 B.岩浆作用
C.流水侵蚀作用 D.变质作用
6.江南园林中常用太湖石构景,形成奇峰怪石的山景。这种山景属于A.喀斯特地貌景观 B.水文地理景观图 C.地质地貌景观 D.人文景观
5-6:江南园林小景 C D
◆地壳内部物质循环的过程。
(2009江苏高考)图3为岩石圈物质循环示意图,图中Ⅰ、Ⅱ、Ⅲ分别代表沉积环境、熔融环境和变质环境,箭头线代表不同的地质过程。读图回答5-6题。
5.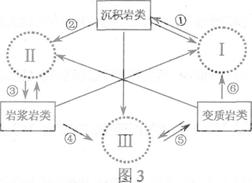 2008北京奥运金牌上镶的昆仑玉和大理岩的形成过程同属
2008北京奥运金牌上镶的昆仑玉和大理岩的形成过程同属
A.② B.③ C.④ D.⑤
6.古生物进入并成为岩石中化石的地质环境和过程是
A.I--① B.Ⅱ--③
C.Ⅲ--⑤ D.⑥--I
2、地表形态变化的内、外力因素。 ◆ 地表形态变化的内力因素
◆褶皱、断层的特点、成因及其地表形态。
◆ 地表形态变化的外力因素

 球为“水半球”)。读图回答3-4题。
球为“水半球”)。读图回答3-4题。
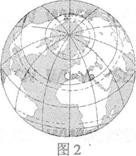
3.“水半球”的极点位于
A.北半球、东半球 B.北半球、西半球
C.南半球、东半球 D.南半球、西半球
4.当夜半球与“陆半球”重叠最多时
A.非洲全部位于昼半球 B.北京市正值下班高峰
C.南极昆仑站处于极昼期 D.江苏各地太阳高度达一年中最大值
g.了解四季的形成原因。
4、地球的圈层结构及各圈层的主要特点。 ◆ 地球的圈层结构
◆各圈层的主要特点
(2007江苏高考)2008年北京奥运会火炬选取了"渊源共生、和谐共融"的"祥云"图案。火炬传递将于2008年3月31日从北京开始,经过国内外135个城市和地区,8月8日传回北京奥运会开幕式主会场。回答15-16题。
15.若火炬由南美洲的布宜诺斯艾利斯(34°36′S, 58°22′W)出发,出发时北京时间为某日凌晨3时,11小时后传递到非洲的达累斯萨拉姆(6°50′S, 39°18′E),火炬到达时当地的区时是
A.前一日15时 B.当日9时 C.前一日22时 D.当日8时
16.火炬在中国境内传递过程中,将经过"乌鲁木齐―敦煌―银川―西安"四个城市。与上述城市相匹配的景观依次是
① 大漠深处的丝路重镇 ② 民族风情浓郁的西域名城③ 城池壮观的历史古都 ④ 渠水环绕的塞外江南
A.①一②一③一④ B.②一④一③一①
C.②一①一④一③ D.④一①一②一③
15-16题:2008年奥运火炬传递B C
c.了解地转偏向力对地表水平运动方向的影响
d.绘制太阳直射点移动轨迹示意图
e.掌握太阳直射点的移动规律
f.掌握昼夜长短及正午太阳高度角纬度变化规律和季节变化规律;
(2007江苏高考)某地是我国重要的人工多层经济林区。
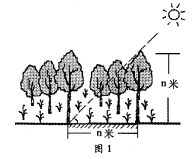
图1为该地"某日太阳处在最高位置时的示意图",此时北京时间为12 : 40,树影遮档地被植物的面积在一年中达到正午时的最大。读图回答1一2题。
1. 该地位于
A. 45°N, 110°E B. 21°34′N, 110°E
C. 45°N, 130°E D. 21°34′N, 130°E
2.这一天
A.太阳距离地球最远 B.江苏省各地昼长夜短
C.晨昏线与极圈相切 D.正午太阳高度由赤道向南北两侧递减
1-2题:人工多层经济林区B C
(2009江苏高考)图2所示为以 N、
N、 为极点的陆地相对集中的“陆半球”(另一半
为极点的陆地相对集中的“陆半球”(另一半
◆最基本的天体、天体系统的结构和等级
◆太阳系概况:成员、八大行星运动特征
◆地球在太阳系中的位置
◆地球是太阳系中一颗既普通又特殊的行星
(2008年江苏卷)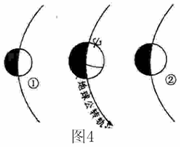 图4为“公转轨道相邻的三大行星相对位置示意图”。读图回答1-2题。
图4为“公转轨道相邻的三大行星相对位置示意图”。读图回答1-2题。
1.此时:
A.是地球上北极地区进行科学考察的黄金季节
B.地球处于近日点附近,公转速度较快
C.我国从南向北白昼变短,黑夜变长
D.②是太阳系中距离太阳、地球最近的大行星
2.与①、②行星相比,地球具备生命存在的基本条件之一是:
A.适宜的大气厚度和大气成份
B.强烈的太阳辐射和充足的水汽
C.复杂的地形和岩石圈
D.强烈的地震和火山活动
2、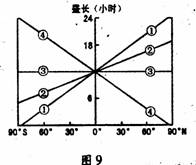 太阳对地球的影响。
◆太阳辐射对地球的影响
太阳对地球的影响。
◆太阳辐射对地球的影响
◆太阳活动及其对地球的影响:太阳大气、太阳活动的主要标志、太阳活动对地球的影响
3、地球运动的地理意义。
◆地球自转的方向、速度和周期
◆地球公转的方向、轨道、速度和周期
◆黄赤交角的地理意义
◆地球自转和公转的地理意义
a.理解昼夜更替及地方时产生的原因
b.能联系实际进行简单的区时计算
(2006江苏)我国“神舟六号”飞始于北京时间2005年10月12日9时许成功发射,17日凌晨安全返回。据此回答16-17题
16.飞船飞行期间,下列叙述正确的是
A.地球绕日公转的速度逐渐减慢 B.太阳直射点向北运动
C.赤道各地日出时,当地物体影子朝向西偏北
D.南半球各地正午太阳高度角达一年中最大值
17.飞船返回时,图9中各线能够表示全球昼长随纬度分布规律的是
A.① B.②
C.③ D.④
24.(10分)工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g~0.5g。已知NaNO2能发生如下反应(方程式已配平):
2NO2-+xI-+yH+=2NO↑+I2+zH2O,请回答下列问题:
(1)上述反应中,x的数值是_______,根据是____________________________;
y的数值是_______,根据是_______________________________________。
(2)根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为___________。
(3)某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是_________。a.NaCl b.H2O2 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为:_________________________________________。
23.(20分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
a |
|
|
|||||||||||||||
|
b |
|
|
|
c |
d |
e |
f |
|
|||||||||
|
g |
h |
i |
j |
|
k |
l |
M |
||||||||||
|
n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素o的基态原子电子排布式
(2)d的氢化物的分子构型为 ,中心原子的杂化形式为 ;k在空气中燃
烧产物的分子构型为 ,中心原子的杂化形式为 ,该分子是
(填“极性”或“非极性”)分子。
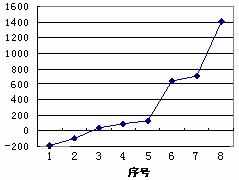 (3)第三周期8种元素按单质熔点高低的顺序如
(3)第三周期8种元素按单质熔点高低的顺序如
右图,其中序号“8”代表 (填元素符号);
其中电负性最大的是 (填右图中的序号)。
(4)由j原子跟c原子以1 : 1相互交替结合而形
成的晶体,晶型与晶体j相同。两者相比熔点
更高的是 ,试从结构角度加以解释:
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间 相互位置关系的平面图如下图丙所示。
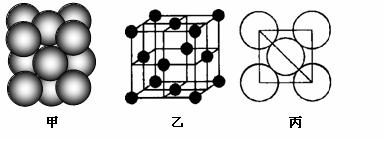
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为___ ___ ,一个晶胞中i原子的数目为_ _。
②该晶体的密度为____ ___(用字母表示)。
22.(10分)在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)
的变化情况如下表:
 实验 实验序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
8 0 0 ℃ |
n2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率为 mol/(L·min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q_ 0(填“>、=、<”),理由是_
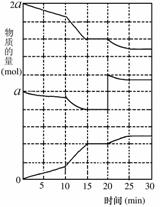 (2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如
右图所示,根据图中所示判断下列说法正确的__ __。
a.10-15 min可能是升高了温度
b.10-15 min可能是加入了催化剂
c.20 min时可能是缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。
反应进行并达到平衡后,测得容器内气体压强为P(始)的 。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的 。
①a、b、c必须满足的关系是 , 。
(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 。
21.(8分)现有常温下的0.1mol·L-1纯碱溶液。
(1)你认为该溶液呈碱性的原因是(用离子方程式表示):
为证明你的上述观点,请设计一个简单的实验,简述实验过程:
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO2-3 离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是
A.c(Na+)=2c(CO2-3 ) B.c(CO2-3 )>c(OH-)>c(HCO-3)>c(H2CO3)
C.c(CO2-3 )+c(HCO-3)=0.1mol·L-1 D.c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3)
(4)水解反应是典型的可逆反应。水解反应的化学平衡常数称为水解常数(用Kh表示),
请写出Na2CO3第一步水解反应的水解常数的表示式:
20.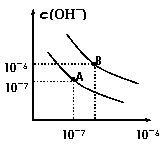 (8分)已知水在25℃和95℃时,
(8分)已知水在25℃和95℃时,
其电离平衡曲线如右图所示:
(1)则25 时水的电离平衡曲线应为
(填“A”或“B”),请说明理由
(2)25时,将=9的NaOH溶液与=4的溶液混合,
若所得混合溶液的 =7,则NaOH溶液与溶液的体积比为
(3)95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后
溶液呈中性,则混合前,该强酸的1与强碱的2之间应满足的关系是
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:
19.(8分)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C+H2O(g)高温CO+H2。C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1;
H2(g)+O2(g)=H2O(g) △H2=-242.0kJ·mol-1;
CO(g)+O2(g)=CO2(g) △H3=-283.0kJ·mol-1;
试回答:
(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程
式:
(2)比较反应热数据可知,1molCO(g)和1 molH2(g)完全燃烧放出的热量之和,比
1molC(s)完全燃烧放出的热量 (填“多”或“少”)。
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量。”
乙同学根据盖斯定律作出了下列循环图
 C(s)+H2O(g)+O2(g) △H1CO2(g)+H2O(g)
C(s)+H2O(g)+O2(g) △H1CO2(g)+H2O(g)
CO(g)+O2(g)+H2(g) △H3CO(g)+H2O(g)+O2(g)
请你写出△H1、△H2、△H3、△H4之间存在的关系式
乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学观点正确的是 (填甲或乙)同学,另一同学出现错误观点的原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com