
10. 设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1 mol C10H22分子中共价键总数为31NA
B.18 g 2H2O中所含的电子总数为10NA
C.24 g NaH中阴离子所含电子总数为NA
D.标准状况下,11.2 L CO2和O2混合气体中含有的氧原子数为2NA
9. X、Y、Z、W都是元素周期表中前20号元素,它们的原子序数依次增大。已知:
① W的阳离子和Z的阴离子具有相同的核外电子排布,且能形成组成为WZ的化合物;
② Z和Y属同族元素,它们能形成两种常见化合物;
③ X和Y属同一周期元素,它们能形成两种气态化合物;
④ W和X能形成组成为WX2的化合物;
⑤ X和Z不在同一周期,它们能形成组成为XZ2的化合物。
下列说法不正确的是
A. XY2是以极性键结合成的非极性分子
 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
B. XY2、XZ2的化学键类型和晶体类型都相同
C. WY、ZY2分子中所有原子最外层都为8电子结构
D. 离子半径大小顺序为Y<W<Z
8. 高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价可看作部分为0价,部分为 -2价。该晶体中的最小重复单元结构如下图所示,则下列说法错误的是
A. 超氧化钾的化学式为KO2
B. 晶体中与每个K+ 距离最近的K+ 有4个
C. 晶体中每个K+ 周围有6个O-2,每个O-2 周围有6个K+
D. 晶体中,0价氧与 -2价氧的原子数目比可看成是3∶1
7. 玻璃棒是化学实验中常用的仪器,下列有关实验过程需要使用玻璃棒进行操作的是
① 用pH试纸测定溶液的pH 

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
② 将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
③ 从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl w_w w.k_s5%
④ 用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
⑤ 用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑥ 实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
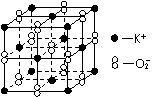 A.①②⑥ B.③④⑥ w_w w.k_s5% C.②④⑤ D.①③⑤
A.①②⑥ B.③④⑥ w_w w.k_s5% C.②④⑤ D.①③⑤
6. 化学与生活、社会密切相关。下列叙述不正确的是
A. 改液化石油气为天然气作燃料,燃烧时应减小进空气量或增大进天然气量
B. 制造生活中的水杯、奶瓶、食物保鲜膜等,使用聚乙烯材料比聚氯乙烯更有利于健康
C. 光导纤维导电能力很强,是一种很好的通讯材料
D. 绿色荧光蛋白质(GFP)是高分子化合物,其水溶液有丁达尔效应
30.(20分)杂种优势是指两个遗传组成不同的亲本杂交产生的F1在生活力、繁殖力、抗逆性、产量和品质等方面都优于双亲的现象。显性假说和超显性假说都可以解释杂种优势。
(1)(4分)显性假说认为杂种优势是由于双亲的各种显性基因全部聚集在F1引起的互补作用。如豌豆有两个纯种(P1和P2)的株高均为1.5-1.8米,但其性状不同,亲代P1多节而节短,亲代P2少节而节长,杂交后F1集中双亲显性基因,多节而节长,可达2.1-2.4米,表现杂种优势。请利用遗传图解和必要文字解释这一现象(多节与节长分别用基因A和B表示)。
(2)(8分)超显性假说则认为等位基因的作用优于相同基因,可以解释杂种优于纯合亲本。例如:豌豆染色体某一位点上的两个等位基因(A1、A2)各抗一种锈病。
①请利用遗传图解和必要文字解释两个只抗一种锈病的纯合亲本杂交后代抗两种锈病的原因。
②若豌豆抗各种锈病性状是由于含有特定蛋白质导致的,请根据基因和蛋白质的关系来分析杂合体抗锈病能力可能高于显性纯合体的原因。____________________。
(3)(8分)假设豌豆高产与低产由两对同源染色体上的等位基因A与a和B与b控制,且A和B控制高产。现有高产与低产两个纯系杂交的F1,F1自交得F2,F2里出现了高产、中高产、中产、中低产、低产五个品系。
①该育种结果支持以上的哪种假说?______________。
②F2里,中产的基因型为_________________________________________________;
③F2里高产、中高产、中产、中低产、低产五个品系性状分离比为_____________。
④若对F2的所有中产豌豆进行测交,后代的表现型和比例为__________________。
29.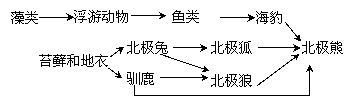 (26分)Ⅰ.(12分)北极熊以在环绕在北极的冰原和浮冰上狩猎为生。在北极地区主要存在如下的海洋食物链和陆地食物链:
(26分)Ⅰ.(12分)北极熊以在环绕在北极的冰原和浮冰上狩猎为生。在北极地区主要存在如下的海洋食物链和陆地食物链:
北极熊处于该两类食物链的顶端,在海洋食物链中,主要食物为海豹,而陆地食物链中的主要食物为驯鹿。全球变暖的趋势影响着北极冰层的生态系统,同时,环境污染使北极熊的生活受到某些有害化学物质的威胁。

 (1)科学家长期跟踪北极熊种群的数量变化和波动情况,发现长期以来北极熊数量的波动主要受食物的影响,而在全球变暖的趋势下,北极熊除种群年龄结构明显表现出_______________ 型的特点外,其种群数量波动特征也和以往存在明显差异,主要表现在______________________________________。
(1)科学家长期跟踪北极熊种群的数量变化和波动情况,发现长期以来北极熊数量的波动主要受食物的影响,而在全球变暖的趋势下,北极熊除种群年龄结构明显表现出_______________ 型的特点外,其种群数量波动特征也和以往存在明显差异,主要表现在______________________________________。
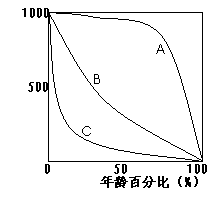
(2)分析北极熊种群的存活曲线,正常情况下,其存活曲线应如右图________所示,由于环境破坏和人为捕杀,北极熊种群存活曲线向B所示类型转化,原因是_____________________________。
(3)最近发现一种含多溴联苯的阻燃剂随被污染的水流和北行风进入了北极,并在北极生物体内被发现,且在北极熊的脂肪组织中该物质的浓度最高。此现象称为_________________________。
(4)由于北冰洋冰封期的缩短,导致北极熊滞留在陆地上的时间延长,则可能导致北极苔原生态系统中苔藓和地衣的数量__________。
Ⅱ.(14分)萘乙酸(NAA)是生产中常用的植物生长素类似物,在一定浓度范围内(50~500ppm)能促进植物生根,且效果比IAA好。但NAA对不同植物促进生根的最佳浓度有较大差异。某校生物兴趣小组的同学,想通过实验探究“NAA促进植物扦插枝条生根的最佳浓度”,请帮助他们完成实验步骤并分析实验结果:
实验目的:探究NAA促进植物扦插枝条生根的最佳浓度。
实验原理:NAA能促进植物扦插枝条生根,有利于插条的存活。在最适浓度下,插条容易生根,存活率也最大。
实验材料:1000ppmNAA原液加清水稀释到浓度分别为: 100ppm、200ppm和300ppm的NAA溶液,茉莉花、桅子花、金钱松枝条,其它必要材料。
(1)实验步骤:
①取250ml烧杯4只,编号。1-3号分别按序加入100-300ppm的萘乙酸溶液50ml,4号加入__________作为对照。
②选长势相当的二年生植物枝条若干(长15cm左右,留顶部2-3片叶,基部的剪除),____________,每组10枝,分别将基部浸入各烧杯溶液中,时间为l小时。
③将各组枝条分别插入沙土中,在适宜条件下培养。
④一个月后,观察各组生根和存活枝条数量,计算成活率。
|
|
|
100 |
200 |
300 |
0(对照) |
||
|
茉莉花 |
7 |
7 |
5 |
2 |
||
|
栀子花 |
10 |
10 |
10 |
10 |
||
|
金钱松 |
0 |
0 |
0 |
0 |
(3)结果分析:
从结果可知,NAA浸泡对茉莉花插条生根的促进效果较好,而另两组未达到实验的预期效果。请分析可能的原因:
栀子花:______________________________________________________________________________。
 金钱松:_____________________________________________________________________________。
金钱松:_____________________________________________________________________________。
(4)在不增加新实验的前提下,请在右面方格纸设计一种适宜方式对实验数据进行处理,并推算出NAA促进茉莉花插条生根的更精确的浓度值。
NAA促进茉莉花插条生根的最佳浓度约为________________。
28、 (14分)A是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。
(14分)A是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。
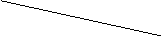
(1) 根据分子结构模型写出A的分子式____________ ,A分子中至少有________个碳原子一定共平面,A的核磁共振氢谱有_______个吸收峰。
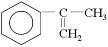 (2)以
为主要原理合成A的路线如下:
(2)以
为主要原理合成A的路线如下:
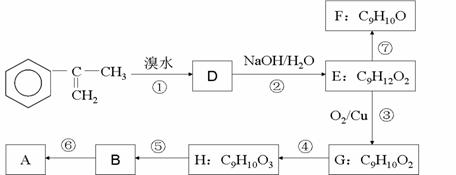
(a)A的合成路线中属于氧化反应的有__________ (填序号)
(b)H的结构简式为___________
(c)写出反应⑥的化学方程式(注明必要的条件)
______________________________________________________________________________________
(d)已知反应⑦为消去反应,有同学试图用酸性KMnO4溶液将F直接氧化成B,你认为该想法能否实现?若能,写出反应的化学方程式,若不能请说明原因。
_________________________________________________________________________________________
(e)G的某同分异构体,苯环上只有一个侧链,且能发生银镜反应和水解反应,写出其可能的结构简式_________________________________________________________________________________________
27、(12分)A-G为中学常见的化合物,它们之间有如图
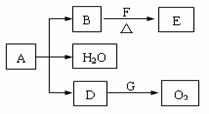 所示的转化关系(反应条件及部分产物已略去)。A为绿色
所示的转化关系(反应条件及部分产物已略去)。A为绿色
粉末,含H、C、O、Cu四种元素。常温下D为无色无味
气体,B为黑色粉末,E能发生银镜反应。请回答:
(1)D跟G反应的化学方程式为_____________________________________;
(2)F中一定含有的官能团的名称为_______________________;

(3)某课外小组同学设计了上述实验装置,通过测定某些装置中试剂的质量变化,探究A中各元素的质量关系。
① 为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
② 向装置中鼓入空气的目的是_________________________________________________________;
丙装置中药品的名称为_______________________________,实验时,该药品未见明显变化,证明_______________________________________________________________________________;
③ 如何判断A已完全分解?____________________________________________________________。
④ 更精确的测定得出如下数据:A受热后完全分解,固体由8.0 g变为6.0 g,装置乙增重0.90 g。写出A的化学式(表示为碱式盐):__________________________________________
26.(15分)为减小和消除由于操作原因CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
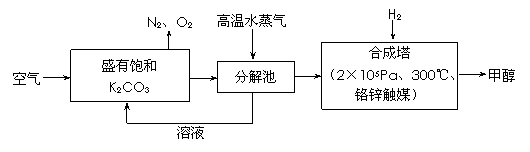
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是 。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e- ==== CO2 + 6H+
则正极发生的反应是
;放电时,H+移向电池的  (填“正”或“负”)极。
(填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3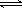 HCO3-+H+ 的平衡常数K =
。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K =
。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-) (填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com