
16.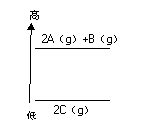 分析右图的能量变化示意图,下列热化学方程式正确的是
( )
分析右图的能量变化示意图,下列热化学方程式正确的是
( )
 A.2A(g)+B(g)=2C(g); ΔH = a (a﹤0)
A.2A(g)+B(g)=2C(g); ΔH = a (a﹤0)
B.2A(g)+B(g)=2C(g); ΔH = a (a﹥0)
C.2A + B = 2C ; ΔH = a (a﹤0)
D.2C = 2A + B ; ΔH = a (a﹥0)
15.已知H-H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据化学方程式:N2(g)+3H2(g)=2NH3(g); ΔH=-92.4kJ·mol-1。则N≡N键的键能是 ( )
A.431kJ·mol-1 B.946kJ·mol-1 C.649kJ·mol-1 D.896kJ·mol-1
14.已知2H2(g)+O2(g)===2H2O(l);ΔH=-569.6 kJ·mol-1,2H2O(g)===2H2(g)+O2(g);ΔH=+482.1 kJ·mol-1。现有1 g液态H2O,蒸发时吸收的热量是 ( )
A.2.43 kJ B.4.86 kJ C.43.8 kJ D.87.5 kJ
13.根据热化学方程式:S(s)+O2(g)===SO2(g);ΔH=-297.23 kJ/mol,分析下列说法中不正确的是 ( )
A.S的燃烧热为297.23 kJ/mol
B.S(g)+O2(g)===SO2(g)放出的热量大于297.23 kJ
|
D.形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量
12.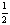 已知Zn(s)+
O2(g)=== ZnO(s);ΔH=-350
kJ/mol,则1 g Zn在氧气中燃烧放出的热量
约为
已知Zn(s)+
O2(g)=== ZnO(s);ΔH=-350
kJ/mol,则1 g Zn在氧气中燃烧放出的热量
约为
A.5.4 kJ B.350 kJ C.3.5 kJ D.8.5 kJ ( )
11.下列说法正确的是 ( )
A.在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B.酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热
C.燃烧热或中和热是反应热的种类之一
D.在稀溶液中,1 mol CH3COOH和1 mol NaOH完全中和时放出的热量为57.3 kJ
10.下列说法中,正确的是 ( )
A.1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热
B.中和反应都是放热反应,盐类水解反应都是吸热反应
C.在101 kPa时,1 mol碳燃烧所放出的热量一定叫碳的燃烧热
D.CO燃烧是吸热反应
9.在一定条件下,CO和CH4燃烧的热化学方程式为:CO(g)+1/2O2=CO2(g) ;△H = -283KJ/mol
CH4(g)+ 2O2=CO2(g) +2H2O(g) ;△H = -890KJ/mol,现有4mol CO和CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为2953 KJ,则CO和CH4的体积比 ( )
A.1:3 B.3:1 C.1:2 D.2:1
8.一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量的饱和石灰水完全吸收可得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量是 ( )
A.0.5Q B. Q C. 2Q D.5Q
7.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ;△H1 , 2H2(g)+O2(g)=2H2O(g) ;△H2,2H2(g)+O2(g)=2H2O(l) ;△H3。常温下取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出热量为 ( )



 A.0.4△H1
+ 0.05△H3
B. 0.4△H1 + 0.05△H2
A.0.4△H1
+ 0.05△H3
B. 0.4△H1 + 0.05△H2



 C.0.4△H1
+ 0.1△H3 D. 0.4△H1
+ 0.2△H3
C.0.4△H1
+ 0.1△H3 D. 0.4△H1
+ 0.2△H3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com