
1.已知M={y|y=x2},N={y|x2+y2=2},则M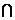 N=
N=
28.(16分)
I(1)a 8.0 ………………………………………………………………………………1分
b 5.0 ………………………………………………………………………………1分
c 15.0 ………………………………………………………………………………1分
(2)搅拌 ………………………………………………………………………………2分
(3)2.5 × 10-5 ……………………………………………………………………3分
(4)反应物浓度增大反应速率加快;反应速率变化和反应物起始浓度变化存在比例关系;反应物浓度对反应速率的影响和化学计量数无关等(只答浓度对化学反应速率有影响给1分) …………………………………………………………………………2分
II(1)①Na2S 溶液、Na2CO3溶液 …………………………………………1分
②NaOH溶液 ……………………………………………………………………1分
(不写溶液扣1分)
(2)沉淀逐渐消失 ……………………………………………………………………2分
(3)加热浓缩,冷却结晶,过滤 ……………………………………………………2分
27.(14分)
(1)c ………………………………………………………………………………2分
(2)Fe-2e-=Fe2+ ………………………………………………………………2分
(3)4Fe2++10H2O + O2= 4Fe(OH)3↓+8H+ ……………………………………3分
(4)①O2+2CO2+4e-=2CO32- (2O2+4CO2+8e-=4CO32-) …………3分
②CO2 ………………………………………………………………………………2分
(5)11.2 ………………………………………………………………………………2分
26.(12分)
 (1)
(1)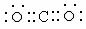 ………………………………………………………2分
………………………………………………………2分
 (2)Fe3O4 ………………………………………………………2分
(2)Fe3O4 ………………………………………………………2分
 (3)O3 + 2I- + 2H+
==== O2 + I2 + H2O ……………………………………3分
(3)O3 + 2I- + 2H+
==== O2 + I2 + H2O ……………………………………3分
(4)c(Na+)> c(OH-) > c(CO32-) > c(HCO3-) ……………………………………2分
(写错1种物质顺序扣1分)
(5)CO2(g) + 3H2(g) === CH3OH(l) + H2O(l) ΔH= -130.9 kJ·mol-1
(热化学方程式2分;反应热1分) ………………………………………………3分
25.(16分)
(1)CH3CH=CH2 ……………………………………………………2分
(2)醛基(写结构简式给分) …………………………………………………2分
(3)

|
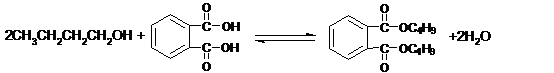
…………………………………………………………………………3分
(化学方程式书写,反应条件、气体、沉淀符号1分,配平1分,化学式或结构简式写错1个扣1分。以下同)
(4)acd ………………………………………………………………………3分
(少写或写错1个扣1分)
(5)减少生成物,使平衡向右移动(向正反应方向、生成DBP的方向均给分;不写平衡移动方向扣2分) ……………………………………………………………………3分
(6)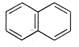 ………………………………………………………………………3分
………………………………………………………………………3分
6.B 7.D 8.C 9.A 10.C 11.D 12.D
24.(5分)某元素的同位素AZX,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置;(写出计算过程)
23.(10分)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
|
实验步骤 |
实验现象 |
|
① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
|
② 向新制得的Na2S溶液中满加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
|
③ 将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
|
④ 将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
|
⑤ 将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
|
⑥ 向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②的化学方程式)
|
实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
实验现象(填A~F) |
|
|
|
|
|
|
实验②的化学方程式: 。
(2)实验结论: 。
22.(13分)下表是元素周期表的一部分,请回答有关问题:
|
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成的两性氢氧化物是 (用化学式表示),写出该物质与⑨最高价氧化物的水化物反应的离子方程式: 。
(3)①②③所形成氢化物的稳定性顺序为: 。
①②④⑤单质的熔点由高到低的顺序: 。
(4) 写出①的氯化物的电子式 ,其空间构型为 ,是 分子。
(5)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
|
实验步骤 |
实验现象与结论 |
|
|
|
21、(12分)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。Y元素原子最外层电子数占核外总电子数的3/4;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族。试回答:
(1)写出元素符号:X__________,Y___________,Z__________,W___________。
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是_______________。
(3)把Z的单质(片状)放入滴有酚酞的沸水中,
反应的化学方程式是_____________________________________。
(4)写出X和Y所形成的化合物的电子式为___________、 。
(5)用电子式表示Z和W所形成的化合物的形成过程为__________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com