
1、培养学生对事物的分析归纳能力。
表2-1 氧化还原反应中反应物与生成物的关系
|
反应物 |
变化特点 |
生成物 |
|
还原剂 |
失、高、氧 |
氧化产物 |
|
氧化剂 |
得、低、还 |
还原产物 |
2.氧化性、还原性强弱的判断 (1)根据元素的化合价 若物质中元素具有最高价,则该元素只有氧化性;物质中元素具有最低价时,该元素只有还原性;物质中元素具有中间价时,该元素既有氧化性又有还原性。对于同一种元素,价态越高,其氧化性就越强;价态越低,其还原性就越强。 (2)根据氧化还原反应方程式
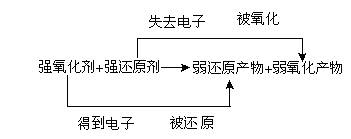
在同一氧化还原反应中,氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。
(3)根据金属活动性顺序表
在金属活动性顺序表中,金属的位置越靠前,其还原性就越强(铂金除外);金属的位置越靠后,其阳离子的氧化性就越强。
(4)根据元素周期表
同周期元素,随着核电荷数的递增,氧化性逐渐增强,还原性逐渐减弱。
同主族元素,随着核电荷数的递增,氧化性逐渐减弱,还原性逐渐增强。
(5)根据反应的难易程度
氧化还原反应越容易进行(表现为反应所需条件越简单),则氧化剂的氧化性和还原剂的还原性就越强。
(6)其它条件
一般溶液的酸性越强或温度越高,则氧化剂的氧化性和还原剂的还原性就越强,反之则越弱。
注意:
①氧化还原性的强弱只与该原子得失电子的难易程度有关,而与得失电子数目的多少无关。得电子能力越强,其氧化性就越强;而失电子能力越强,其还原性就越强。
②同一元素相邻价态间不发生氮化还原反应。
二、氧化还原反应方程式的配平
1.依据原则
在氧化还原反应中,元素得失电子的总数(或化合价升降的总数)相等。
2.配平方法
一标、二找、三定、四平、五查。(具体参见下面的例题)
思维技巧点拔
一、氧化性和还原性强弱的判断
[例1] 根据反应式:(1) 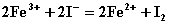 ,(2)
,(2) 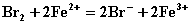 ,可判断离子的还原性从强到弱的顺序是
,可判断离子的还原性从强到弱的顺序是
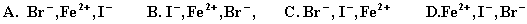 解析:
根据“氧化剂+还原剂=氧化产物+还原产物”中“氧化剂的氧化性>氧化产物,还原剂的还原性>还原产物”,根据⑴有还原性I->Fe2+,根据⑵有还原性Fe2+>Br-。
正确选项为:B。
[例2] G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的分子式(或化学式),但知道它们在一定条件下具有如下的转换关系(未配平)
解析:
根据“氧化剂+还原剂=氧化产物+还原产物”中“氧化剂的氧化性>氧化产物,还原剂的还原性>还原产物”,根据⑴有还原性I->Fe2+,根据⑵有还原性Fe2+>Br-。
正确选项为:B。
[例2] G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的分子式(或化学式),但知道它们在一定条件下具有如下的转换关系(未配平)
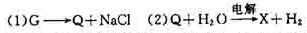
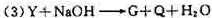
 这五种化合物中氯元素的化合价由低到高的顺序为
这五种化合物中氯元素的化合价由低到高的顺序为
 [解析]
根据氧化还原反应的特征可知,氧化还原反应中元素化合价有升必有降。由(1)得化合价Q>G,因为该反应为歧化反应,G中氯元素的化合价必介于Q和-1价氯之间。同理由(3)结合(1)得化合价Q>Y>G,由(2)得化合价X>Q,由(4)结合(2)得化合价X>Z>Q。
正确答案为:B。
二、氧化还原反应方程式配平的常见题型
1.定项配平
[例3] 配平下列方程式,将系数填在空格内:
[解析]
根据氧化还原反应的特征可知,氧化还原反应中元素化合价有升必有降。由(1)得化合价Q>G,因为该反应为歧化反应,G中氯元素的化合价必介于Q和-1价氯之间。同理由(3)结合(1)得化合价Q>Y>G,由(2)得化合价X>Q,由(4)结合(2)得化合价X>Z>Q。
正确答案为:B。
二、氧化还原反应方程式配平的常见题型
1.定项配平
[例3] 配平下列方程式,将系数填在空格内:
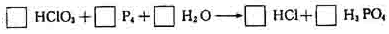 [解析]
分析反应前后Cl和P的化合价变化,每个氯原子由
[解析]
分析反应前后Cl和P的化合价变化,每个氯原子由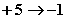 ,化合价升高数为6,而每个P原子化合价由0变为+5,P4中4个P的原子降低数为20,由最小公倍数可得HClO3前的系数为10,P4前的系数为3,其它元素原子的系数使用观察法配平。配平的中间步骤可表示如下:
,化合价升高数为6,而每个P原子化合价由0变为+5,P4中4个P的原子降低数为20,由最小公倍数可得HClO3前的系数为10,P4前的系数为3,其它元素原子的系数使用观察法配平。配平的中间步骤可表示如下:
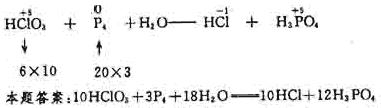 2.缺项配平
[例4] 完成并配平下列化学方程式:
2.缺项配平
[例4] 完成并配平下列化学方程式:
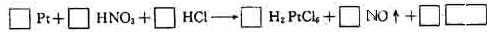 解析:
解析:
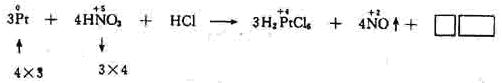 比较反应式两边的原子或原子团可知,右边有18个
比较反应式两边的原子或原子团可知,右边有18个 离子,左边只有1个
离子,左边只有1个 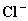 离子,应在HCl前加18,再比较反应式两边H、O原子个数不等。可见未知生成物中含有氢、氧元素,未知物应为水,由原子个数守恒得系数为8。
本题答案为:
离子,应在HCl前加18,再比较反应式两边H、O原子个数不等。可见未知生成物中含有氢、氧元素,未知物应为水,由原子个数守恒得系数为8。
本题答案为:
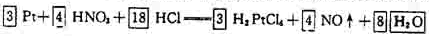 3.未知量配平
[例5] 由硫可得多硫化钠Na2Sx,x值一般为2-6,已知Na2Sx与NaClO反应的化学方程式如下:
3.未知量配平
[例5] 由硫可得多硫化钠Na2Sx,x值一般为2-6,已知Na2Sx与NaClO反应的化学方程式如下:
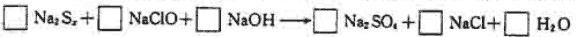 试配平上述方程式,若某多硫化钠在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试以求得的x值写出该多硫化钠的分子式_________。
[解析]
本题解答的关键必须正确标出Na2Sx中硫的化合价,由化合物中化合价的代数和等于零这一原则得硫的化合价为
试配平上述方程式,若某多硫化钠在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试以求得的x值写出该多硫化钠的分子式_________。
[解析]
本题解答的关键必须正确标出Na2Sx中硫的化合价,由化合物中化合价的代数和等于零这一原则得硫的化合价为 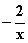 。分析反应前后元素的化合价变化情况,硫元素由
。分析反应前后元素的化合价变化情况,硫元素由 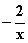 升高到+6价,每个硫原子净升高级为
升高到+6价,每个硫原子净升高级为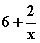 ,x个硫原子共升高6x+2,NaClO中氯元素的化合价由+1降到-1价,净降低数为2,根据最小公倍数可得Na2Sx前的系数为1,NaClO和NaCl前的系数为3x+1。
,x个硫原子共升高6x+2,NaClO中氯元素的化合价由+1降到-1价,净降低数为2,根据最小公倍数可得Na2Sx前的系数为1,NaClO和NaCl前的系数为3x+1。
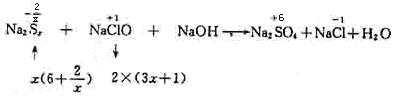 其它物质前面的系数使用观察法配平。
本题答案为:
其它物质前面的系数使用观察法配平。
本题答案为:
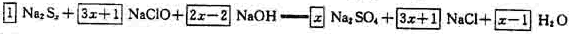 根据“反应中消耗的NaClO和NaOH的物质的量之比为2:1”有
根据“反应中消耗的NaClO和NaOH的物质的量之比为2:1”有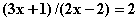 ,算出x=5。多硫化钠的化学式为Na2S5。
4.有机氧化还原反应方程式配平
[例6]
,算出x=5。多硫化钠的化学式为Na2S5。
4.有机氧化还原反应方程式配平
[例6]
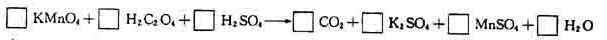 当KMnO4消耗0.05mol时,产生的CO2的体积为_______L(标准状况)。
[解析]
有机氧化还原反应方程式的配平与无机氧化还原反应方程式相似,关键是正确标定有机物中碳的化合价。为了方便地标出碳的化合物,在遇到有机物用结构简式表示时,一定要把它写成分子式。
当KMnO4消耗0.05mol时,产生的CO2的体积为_______L(标准状况)。
[解析]
有机氧化还原反应方程式的配平与无机氧化还原反应方程式相似,关键是正确标定有机物中碳的化合价。为了方便地标出碳的化合物,在遇到有机物用结构简式表示时,一定要把它写成分子式。
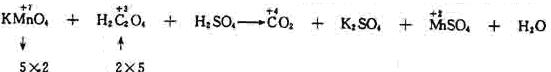 根据最小公倍数,可得KMnO4和MnSO4前的系数为2,H2C2O4前的系数为5,其它使用观察法配平。配平后的反应式可得关系式2 KMnO4-10CO2,设产生CO2的体积为xL,由2:224=0.05:x解得x=5.6。
本题正确答案为:
根据最小公倍数,可得KMnO4和MnSO4前的系数为2,H2C2O4前的系数为5,其它使用观察法配平。配平后的反应式可得关系式2 KMnO4-10CO2,设产生CO2的体积为xL,由2:224=0.05:x解得x=5.6。
本题正确答案为:
 三、有关氧化还原反应的计算
[例7] 一定条件下硝酸铵受热分析的未配平化学方程式为
三、有关氧化还原反应的计算
[例7] 一定条件下硝酸铵受热分析的未配平化学方程式为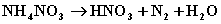 ,在反应中被氧化与被还原的氮原子之比为( )
A.1:1 B.5:4 C.5:3 D.3:5
[解析]
本题使用电子守恒法解答比较简单,本反应的实质是
,在反应中被氧化与被还原的氮原子之比为( )
A.1:1 B.5:4 C.5:3 D.3:5
[解析]
本题使用电子守恒法解答比较简单,本反应的实质是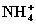 中-3价氮和
中-3价氮和 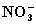 中+5价氮归中变为N2中的0价氮。
N:-3→0 ↑3×5
N:+5→0 ↓5×3
由上可知,被氧化与被还原的氮原子个数比为5:3。
本题正确答案为:C。
中+5价氮归中变为N2中的0价氮。
N:-3→0 ↑3×5
N:+5→0 ↓5×3
由上可知,被氧化与被还原的氮原子个数比为5:3。
本题正确答案为:C。
高考名题赏析
例1:在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的( )
(A)原子数 (B)密度 (C)质量 (D)质子数
(2003年全国理综试题)
解析:
根据阿伏加德罗定律:同温同压同体积的气体具有相同的物质的量。则本题n(HCl)=n(H2)+n(Cl2),因为无论是H2、O2还是HCl均为双原子分子,所以在该条件下,两容器中一定具有相同的原子数,但由于H2与Cl2的体积比不定,故不能确定密度、质量和质子数是否相同。
综上分析,本题答案为:(A)。
例2:要配制浓度约为2mol·L-1NaOH溶液100mL,下面的操作正确的是( )
(A)称取8gNaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
(B)称取8gNaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
(C)称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水到刻度,盖好瓶塞,反复摇匀
(D)用100mL量筒量取40mL5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
(2003年全国高考试题)
解析:
本题需要明确以下几点:
①溶质(NaOH)质量或浓溶液体积是否正确;
②NaOH固体溶于水放热,不能在量器(量筒和容量瓶)中溶解;
③粗略配制一定物质的量浓度的溶液不一定要严格按照:计算→称量→溶解→转移→洗涤→定容→摇匀的步骤在容量瓶中配制。
明确了上述几个问题,本题不难得出答案:(A)、(D)。
例3:若1.8g某金属跟足量盐酸充分反应,放出2.24L(标准状况)氢气,则该金属是( )
A.Al B.Mg C.Fe D.Zn
(2004全国老课程卷)
解析:
可设金属显+2价,则放出2.24LH2对应金属为0.1mol,所以金属的摩尔质量为18g/mol。
答案:A
例4:用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.0.1mol·L-1稀硫酸100mL中含有硫酸根个数为0.1NA
B.1molCH3+(碳正离子)中含有电子数为10NA
C.2.4g金属镁与足量的盐酸反应,转移电子数为 2NA
D.12.4g白磷中含有磷原子数为0.4NA
(2004北京理综)
答案:D
解析:
考查的知识点为“物质的量及物质的量浓度、粒子数目、氧化还原反应中得失电子数目”。
A:H2SO4 2H++SO42-c(SO42-)=0.1mol/L,V=0.1L。
∴n(SO42-)=0.1mol/L×0.1L=0.01mol
2H++SO42-c(SO42-)=0.1mol/L,V=0.1L。
∴n(SO42-)=0.1mol/L×0.1L=0.01mol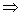 0.01NA(A错);
B:CH3+1mol中含8mol电子,∴电子数应为8NA,(B错)
C:Mg+2H+→Mg2++H2↑转移电子
24g 2NA
2.4g 0.2NA(C错)
D:考查白磷的化学式P4,1mol P4中有4NA磷原子。12.4g相当于0.1mol P4
∴有0.4 NA磷原子(正确)。
例5:下列说法不正确的是 ( )
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02 ×1023个氮分子和6.02×1023个氢分子的质量比等于14:1
C.32 g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5 ×6.02 ×1023个一氧化碳分子所占体积是11.2 L
(2004全国卷Ⅰ)
答案:D
解析:
常温常压不是标准状况,故气体摩尔体积不是22.4 L/mo1。
例6:
0.01NA(A错);
B:CH3+1mol中含8mol电子,∴电子数应为8NA,(B错)
C:Mg+2H+→Mg2++H2↑转移电子
24g 2NA
2.4g 0.2NA(C错)
D:考查白磷的化学式P4,1mol P4中有4NA磷原子。12.4g相当于0.1mol P4
∴有0.4 NA磷原子(正确)。
例5:下列说法不正确的是 ( )
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02 ×1023个氮分子和6.02×1023个氢分子的质量比等于14:1
C.32 g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5 ×6.02 ×1023个一氧化碳分子所占体积是11.2 L
(2004全国卷Ⅰ)
答案:D
解析:
常温常压不是标准状况,故气体摩尔体积不是22.4 L/mo1。
例6: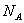 代表阿伏加德罗常数值,下列说法正确的是( )
A.9g重水所含有的电子数为
代表阿伏加德罗常数值,下列说法正确的是( )
A.9g重水所含有的电子数为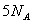 B.1mol
MgCl2中含有离子数为
B.1mol
MgCl2中含有离子数为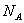 C.
C. 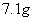 氯气与足量NaOH溶液反应转移的电子数为
氯气与足量NaOH溶液反应转移的电子数为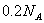 D.1molC10H22分子中共价键总数为
D.1molC10H22分子中共价键总数为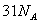 (2004天津卷)
答案:D
解析:
1mol C10H22分子中有9mol C-C键,22mol C-H键,共有共价键31NA。
例7:阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是( )
A.标准状况下,2.24L苯中约含有3.612x1023个碳原子
B.常温常压下,氧气和臭氧的混合物16g中约含有6.02×1O23个氧原子
C.25℃时,1 L pH=13的氢氧化钠溶液中约含有6.02×l023个氢氧根离子
D.0.5mol
CH4中约含有3.01×1024个电子
(2002江苏卷)
答案:BD
解析:
标况下苯不是气体,2.24L苯不是0.1mo1,故A项不正确;25℃时,1L pH=13的NaOH溶液含OH-
0.1mo1,约含有6.02×1022个OH-离子,故C项不正确;所以选B、D。
例8:等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的
(2004天津卷)
答案:D
解析:
1mol C10H22分子中有9mol C-C键,22mol C-H键,共有共价键31NA。
例7:阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是( )
A.标准状况下,2.24L苯中约含有3.612x1023个碳原子
B.常温常压下,氧气和臭氧的混合物16g中约含有6.02×1O23个氧原子
C.25℃时,1 L pH=13的氢氧化钠溶液中约含有6.02×l023个氢氧根离子
D.0.5mol
CH4中约含有3.01×1024个电子
(2002江苏卷)
答案:BD
解析:
标况下苯不是气体,2.24L苯不是0.1mo1,故A项不正确;25℃时,1L pH=13的NaOH溶液含OH-
0.1mo1,约含有6.02×1022个OH-离子,故C项不正确;所以选B、D。
例8:等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的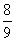 (同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
A.3:4:1 B.3:3:2 C.6:7:3 D.6:9:10
(2004上海卷)
答案:A
解析:
由题给的体积变化可设原有9L气体,N2、O2、CO2三种气体各3L;由
(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
A.3:4:1 B.3:3:2 C.6:7:3 D.6:9:10
(2004上海卷)
答案:A
解析:
由题给的体积变化可设原有9L气体,N2、O2、CO2三种气体各3L;由 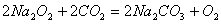 可知,9体积N2、O2、CO2与Na2O2反应后变应为8体积,说明有2体积CO2反应,同时生成1体积O2,所以,反应后三种气体的体积比为
可知,9体积N2、O2、CO2与Na2O2反应后变应为8体积,说明有2体积CO2反应,同时生成1体积O2,所以,反应后三种气体的体积比为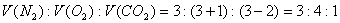 ,故选A。
例9:设NA为阿伏加德罗常数。下列叙述中正确的是 ( )
A.46g NO2和N2O4混合气体中含有原子数为3NA
B.标准状况下22.4 L H2中含中子数为2NA
C.1 L 1mol/L醋酸溶液中离子总数为2NA
D.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
(2004上海卷)
答案:AD
解析:
H2的中子数为0,故B项不正确;醋酸为弱电解质,不完全电离,故C项不正确,所以选AD。
例10:久置空气中会发生颜色变化,但颜色变化不是由于跟氧气反应引起的物质是(
)
A.过氧化钠固体 B.亚硫酸钠固体 C.硫酸业铁晶体 D.苯酚晶体
(2004老课程)
答案:A
解析:
Na2O2本身淡黄色,在空气中易与水和CO2反应生成白色的固体;Na2SO3本身无色,易被O2氧化生成硫酸钠; FeSO4·7H2O本身淡绿色,易被氧化成红褐色的+3铁的化合物;无色的苯酚易被氧化成粉色的物质。
例11:为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( )
A.Na2SO3溶液(BaCl2) B.FeCl2溶液(KSCN)
C.KI(淀粉溶液) D.HCHO溶液(石蕊试液)
(2004北京理综)
答案:A
解析:
A:Na2SO3在空气中变质成Na2SO4,用BaCl2检验其是否变质,不能达到目的,Na2SO3、Na2SO4与BaCl2反应均有白色沉淀产生。
B:FeCl2与KSCN无明显现象,当Fe2+→Fe3+后,溶液立即变血红色。
C:KI(淀粉溶液)中I-与淀粉溶液相遇无明显变化,但当I-→I2时溶液立即呈蓝色。
D:HCHO溶液氧化生成HCOOH,甲酸可使紫色石蕊变红,而甲醛与石蕊不作用。∴B、C、D中检验试剂均可达到目的。
例12:从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O====7Cu2S↓+5FeSO4+12H2SO4,下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5molFeS2发生反应,有10mol电子转移
C.产物中的SO42-离子有一部分是氧化产物
D.FeS2只作还原剂
(2004北京理综)
答案:C
解析:
考查的知识点是“氧化还原反应中氧化产物,还原产物,氧化剂还原剂概念的辨析,反应中电子转移数目的判断”。
14CuSO4+5FeS2+12H2O=7Cu2S↓+5FeSO4+12H2SO4,反应中
,故选A。
例9:设NA为阿伏加德罗常数。下列叙述中正确的是 ( )
A.46g NO2和N2O4混合气体中含有原子数为3NA
B.标准状况下22.4 L H2中含中子数为2NA
C.1 L 1mol/L醋酸溶液中离子总数为2NA
D.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
(2004上海卷)
答案:AD
解析:
H2的中子数为0,故B项不正确;醋酸为弱电解质,不完全电离,故C项不正确,所以选AD。
例10:久置空气中会发生颜色变化,但颜色变化不是由于跟氧气反应引起的物质是(
)
A.过氧化钠固体 B.亚硫酸钠固体 C.硫酸业铁晶体 D.苯酚晶体
(2004老课程)
答案:A
解析:
Na2O2本身淡黄色,在空气中易与水和CO2反应生成白色的固体;Na2SO3本身无色,易被O2氧化生成硫酸钠; FeSO4·7H2O本身淡绿色,易被氧化成红褐色的+3铁的化合物;无色的苯酚易被氧化成粉色的物质。
例11:为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( )
A.Na2SO3溶液(BaCl2) B.FeCl2溶液(KSCN)
C.KI(淀粉溶液) D.HCHO溶液(石蕊试液)
(2004北京理综)
答案:A
解析:
A:Na2SO3在空气中变质成Na2SO4,用BaCl2检验其是否变质,不能达到目的,Na2SO3、Na2SO4与BaCl2反应均有白色沉淀产生。
B:FeCl2与KSCN无明显现象,当Fe2+→Fe3+后,溶液立即变血红色。
C:KI(淀粉溶液)中I-与淀粉溶液相遇无明显变化,但当I-→I2时溶液立即呈蓝色。
D:HCHO溶液氧化生成HCOOH,甲酸可使紫色石蕊变红,而甲醛与石蕊不作用。∴B、C、D中检验试剂均可达到目的。
例12:从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O====7Cu2S↓+5FeSO4+12H2SO4,下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5molFeS2发生反应,有10mol电子转移
C.产物中的SO42-离子有一部分是氧化产物
D.FeS2只作还原剂
(2004北京理综)
答案:C
解析:
考查的知识点是“氧化还原反应中氧化产物,还原产物,氧化剂还原剂概念的辨析,反应中电子转移数目的判断”。
14CuSO4+5FeS2+12H2O=7Cu2S↓+5FeSO4+12H2SO4,反应中 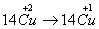 ,
, 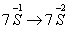 降低总数为21,显然还有
降低总数为21,显然还有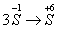 ,故反应后有17SO42-(+6价S),而反应前有14SO42-,可见Cu2S只是还原产物,5mol FeS2参加反应转移电子数为21mol ,部分SO42-为氧化产物,FeS2既是作氧化剂,又做还原剂,∴选项C为正确答案,此题有一定难度。
例13:在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入
,故反应后有17SO42-(+6价S),而反应前有14SO42-,可见Cu2S只是还原产物,5mol FeS2参加反应转移电子数为21mol ,部分SO42-为氧化产物,FeS2既是作氧化剂,又做还原剂,∴选项C为正确答案,此题有一定难度。
例13:在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入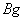 该无水盐,保持温度不变,析出R的结晶水合物Wg,从原饱和溶液中析出溶质R的质量为( )
A.
该无水盐,保持温度不变,析出R的结晶水合物Wg,从原饱和溶液中析出溶质R的质量为( )
A. 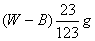 B.
B. 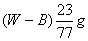 C.
C. 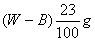 D.
D. 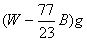 (2004天津理综)
答案:A
解析:
从原溶液中析出的溶液质量为(Wg-Bg),所以从原饱和溶液中析出溶质R的质量为:
(2004天津理综)
答案:A
解析:
从原溶液中析出的溶液质量为(Wg-Bg),所以从原饱和溶液中析出溶质R的质量为: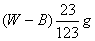 例14:某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 +
KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是 ____________。
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是________________
②在下面的化学式上标出电子转移的方向和数目
KMnO4+ KI+ H2SO4
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是
________________________________________________________________。
例14:某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 +
KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是 ____________。
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是________________
②在下面的化学式上标出电子转移的方向和数目
KMnO4+ KI+ H2SO4
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是
________________________________________________________________。
47.(8分)在下图中,左图所示人体内血糖调节的部位图解,图中a、b表示参与血糖调节的两种激素,右图表示a激素信息传递的一种机制。请回答:
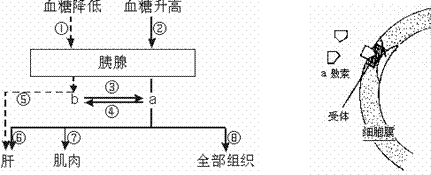
(1)正常人的血糖浓度为 g/L。
(2)当血糖升高时,通过②过程,使a分泌量增加,a激素表示 ,它在降低血糖过程中具体的调节作用有两个方面,一是通过⑥⑦⑧过程促进
;二是主要通过⑥抑制 。
(3)图中b激素是 ,它与a激素的作用关系表现为 ,a激素和b激素的作用结果都会反过来影响各自的分泌,这种调节方式称为 调节。
(4)Ⅱ型糖尿病人的a激素的含量和正常人相差很小,甚至比正常人还高,请据上右图激素作用的机制分析Ⅱ型糖尿病人最可能的病因是:
。
46.(6分)2007年,陕西镇坪“华南虎”事件重新引起了人们对这种濒危生物的关注。华南虎(又称中国虎)是我国特有的亚种,全球只剩下不到100只,在野外生存的华南虎可能只有l0到30只。一只虎至少需要15到30平方公里活动空间,影响它们数量的首要原因是人虎冲突。近代的人口迅速增长,导致华南虎的栖息地碎裂化、岛屿化,很难满足华南虎的生存和繁殖的要求。第二个原因就是华南虎的很多食物是人类的经济动物,当人们的猎杀使这些动物的种群密度降低到一定程度时,华南虎已经很难生存。
(1)华南虎和东北虎均为我国国家一级保护动物,它们属于一个物种的两个不同亚种。从进化的角度看,其差异的实质是种群 不同。
 (2)野外的成年华南虎通常将尿液喷洒在树枝上作为确定它们领地的一种标志,这是一种
信息。
(2)野外的成年华南虎通常将尿液喷洒在树枝上作为确定它们领地的一种标志,这是一种
信息。
(3)右图是能量流经华南虎种群的示意图,其中
A表示华南虎的摄入量,B表示华南虎的同化量。
那么,D、E依次表示华南虎的 、
。而要确保华南虎的能量需求,
其生存领地的相关植物所固定的能量至少应到达 。
(4)如果陕西镇坪存在华南虎,对该区域内的华南虎最好的保护方式是:
。
45.(9分)下图是反射弧的组成示意图(虚线内为神经中枢),请据图回答:

(1)图中的 是感受器,图中的兴奋传导方向是 (以数字编号作答)。
(2)图中箭头表示人体内神经冲动的传导方向,其中错误的是 处(填箭头旁字母),该如何改正? 。
(3)图中表示神经元之间的突触有 个。
(4)若图中的有关感受器位于大腿,则图中所示的神经中枢位于 ,经改正后的方向中,向大脑皮层传递信号的是 ,由大脑皮层传来指令的可能是 。当④受到刺激而②损伤时, (能或不能)产生感觉。
44.(12分)下列甲图表示洋葱根尖的不同区域;乙图表示洋葱根尖处于有丝分裂各阶段细胞核中DNA和细胞质中mRNA含量变化;丙图呈现的是细胞分裂过程中的一种物质变化和形态变化。请分析回答下列问题:

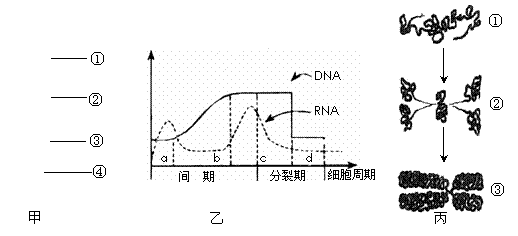

(1)在放射性同位素标记研究中,为区别DNA和RNA,最好选择标记的合成原料分别是 、
|
(2)进行分裂的细胞集中在甲图中的[③] 。该区域的细胞中能产生ATP的细胞器有 。
(3)研究表明细胞的呼吸速率在各时期是不同的,乙图中c阶段后期耗氧最多,这与分裂期需要大量的 相适应。c阶段细胞核DNA、染色体与染色单体的比例为 ,这种比例将维持到细胞有丝分裂的 期才可能开始变化。
(4)乙图表明细胞分裂过程中核糖体功能较活跃的时期是 (填字母),这也说明在上述时期进行了大量 的合成。
(5)丙图呈现了一种物质变化和形态变化过程,①→②的物质变化对应于乙图中的时期是 (填字母);②→③的形态变化对应于乙图中的时期是 (填字母)。
(6)在观察有丝分裂实验时,我们发现即使操作正确,也难以看到很多处于分裂期的细胞,主要原因是 。
43.(6分)我国中科院上海生化所合成了一种具有镇痛作用而不会像吗啡那样使病人上瘾的药物,药物的合成是采用的蛋白质工程技术,这是在生物发展分子水平上的又一突破。下面是它的结构简式。据此化合物的结构分析回答:

(1)该化合物中有 种氨基酸构成,图中氨基酸种类不同,是因为 基团不同。
(2)形成该化合物的反应叫做 。反应在 (细胞器)上进行。
(3)该化合物称 肽。水解时被破坏的化学键为 (写化学式)。
42.(10分)基因兴奋剂是指通过改良遗传学成分来使机体产生更多激素、蛋白质或其他天然物质,从而增进运动能力。基因兴奋剂是随着基因治疗技术的发展而诞生的,它与普通基因治疗的不同在于将服务对象从患者转移到了健康的职业运动员。
科学家发现一种AGTN3的基因,其等位基因R能提高运动员的短跑成绩,其另一等位基因E则能提高运动员的长跑成绩。请回答下列问题:
(1)基因AGTN3变成基因R或E的现象在遗传学上称为 ,该现象发生的本质原因是DNA分子发生了 。
(2)若一个家庭中,父母都具有E基因,善长跑;一个儿子也具有E基因,善长跑;但另一个儿子因不具有E基因而不善长跑。据孟德尔理论,这种现象在遗传学上称为 。并由此可见,E基因对AGTN3基因为 (显性或隐性)。
(3)据达尔文的自然选择学说,多狮豹的非洲某部落中 基因出现后的比例会加大,基因E在该种群中的比例叫做 。
(4)基因通过控制蛋白质的合成来控制人的各种性状。基因R控制人体有关蛋白质的合成过程包括 两个阶段。参与该过程的核酸共含有 种核苷酸。
(5)科学家把运动员注入的能改善运动员各种运动能力和耐力的基因称为基因兴奋剂。并预言,随着转基因技术的提高,在以后的奥运会上将出现使用基因兴奋剂这种最隐蔽的作弊行为。这是因为注入的基因存在于运动员的
A.血液中 B.肌肉中 C.心脏中 D.小脑中
(6) 若一对夫妇因注射了R基因都提高了短跑成绩,则他们在这以后所生子女具有R基因的概率为
A.100% B.75% C.25% D.0
41.(9分)下图是动物不同细胞分裂阶段的图像,请据图回答:

(1)图像中表示动物的体细胞的有 ,表示初级精母细胞的有 ,表示次级精母细胞的有 。
(2)图A中的细胞有 条染色体, 条染色单体, 个DNA分子。
(3)图B中有 个四分体,该图与图A、图C若表示同一细胞的不同分裂时期,则三图表示细胞分裂的正确顺序是 。
(4)以染色体组合种类为标准,具有图B表示的那种细胞的动物,其减数分裂能生成__________种类型的精子(或卵细胞)。
40.下图为利用纯合高秆(D)抗病(E)小麦和纯合矮秆(d)染病(e)小麦快速培育纯合优良小麦品种矮秆抗病小麦(ddEE)的示意图,有关此图叙述不正确的是

A.图中进行①过程的主要目的是让控制不同优良性状的基因组合到一起
B.②过程中发生了非同源染色体的自由组合
C.实施③过程依据的主要生物学原理是细胞增殖
D.④过程的实施中通常用一定浓度的秋水仙素
第Ⅱ卷(非选择题共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com