
4.“变”--任何化学平衡状态均是暂时的、相对的、有条件的(与浓度、压强、温度等有关)。而与达平衡的过程无关(化学平衡状态既可从正反应方向开始达平衡,也可以从逆反应方向开始达平衡)。当外界条件变化时,原来的化学平衡即被打破,在新的条件不再改变时,在新的条件下建立起新的化学平衡。新平衡时正、逆反应速率,各组成成分的含量均与原平衡不同。
3.“动”--指定化学反应已达化学平衡状态时,反应并没有停止,实际上正反应与逆反应始终在进行,且正反应速率等于逆反应速率,所以化学平衡状态是动态平衡状态。
2.“定”--当一定条件下可逆反应一旦达平衡(可逆反应进行到最大的程度)状态时,在平衡体系的混合物中,各组成成分的含量(即反应物与生成物的物质的量,物质的量浓度,质量分数,体积分数等)保持一定而不变(即不随时间的改变而改变)。这是判断体系是否处于化学平衡状态的重要依据。
特点:
1.“等”--处于密闭体系的可逆反应,化学平衡状态建立的条件是正反应速率和逆反应速率相等。即v(正)=v(逆)≠O。这是可逆反应达到平衡状态的重要标志。
2.外因:
(1).浓度:浓度越大,单位体积内活化分子数增多,分子之间有效碰撞机会增加,发生化学反应的几率加大,化学反应速率就快;因此,化学反应速率与浓度有密切的关系,浓度越大,化学反应速率越快。增大反应物的浓度,正反应速率加快,增大生成物浓度逆反应速率增大,反应物、生成物浓度变化相同倍率时,正、逆反应速率变化的倍率与正、逆反应反应物的分子数有关。
(2).温度:温度越高,反应速率越快(正、逆反应速率都加快,但吸热反应速率加快程度更大,反之,亦然。)
(3).压强:对于有气体参与的化学反应, 压强变化→体积变化→浓度变化→速率变化(对于可逆反应,反应物和生成物的浓度都增大,正逆反应速率都增大,但反应物分子数多的一侧反应速率增加更快,反之,亦然)。
(4).催化剂:改变化学反应速率(对于可逆反应使用催化剂可以同等程度地改变正逆反应速率)。
1.内因:反应物本身的性质.
3. 相互关系:4NH3 + 5O2  4NO + 6H2O(g)
4NO + 6H2O(g)
v(NH3):v(O2): v(NO) : v(H2O) = 4:5:4:6
2.单位:mol/(L·s) ;mol/(L·min);mmol/(L·s)。
1.表示方法:v = △c/△t
27、如图是“测定玻璃的折射率”实验结果的一张记录图.
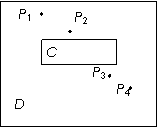 (1)表示实物的符号:C是
,P1、P2、P3、P4是 。
(1)表示实物的符号:C是
,P1、P2、P3、P4是 。
(2)根据实验记录在图中完成光路图.
(3)若提供量角器,则必测的量是 ,被测玻璃的折射率的表达式n = .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com