
6.罗马法从形式上分包括 ( )
A.成文法 B.习惯法 C.成文法和习惯法 D.公法和私法
6.明清之际出现了反封建的民主思想,根本原因是 ( )
A.政治的腐败 B.人民的反抗
C.商品经济的发展 D.程朱理学的因循守旧
5.以下对明清时期思想特点表述不正确的是 ( )
A.理学由主观唯心主义向客观唯心主义演变
B.理学和心学相继占统治地位
C.王阳明把程朱理学发展为心学
D.理学、心学和早期民主启蒙思潮并存
4.从战国“百家争鸣”到西汉“独尊儒术”的转变体现了 ( )
①中央集权的强化 ②思想控制的加强
③大一统局面的形成 ④儒家以外各学派的消亡
A.②④ B.①②④ C.①③ D.①②③
3.汉武帝时期,儒家思想开始成为封建社会的统治思想,主要是因为 ( )
A.道家“无为”思想不能解决现实问题
B.汉武帝务需从“无为”转向“有为”
C.董仲舒提出了“罢黜百家,独尊儒术”的建议
D.经董仲舒改造后的儒学有利于汉武帝的“大一统”
2.某欧洲文化旅游团在一所中学图书馆参观时问学生,“’Fhe river can carry a boat,yet,it can turn the boat
over as well'’,把君主和百姓的关系比做舟和水,这句话最早见于中国哪位古代思想家的著作?这位学生正确的回答应是 ( )
A.Li Er B.Zhuang Zhou C.Meng Ke D.Xun Kuang
1.春秋战国时期出现“百家争鸣”局面的原因不包括 ( )
A.社会处于新旧制度交替的变革时代
B.思想家著书立说的政治环境比较宽松
c.私人授徒讲学在当时蔚然成风
D.封建地主阶级治国模式大体确定下来
28、(15分)苯乙烯是一种重要的化工合成原料,现由苯乙烯合成聚三溴代苯乙烯和另外一种高聚物M的工艺如下:
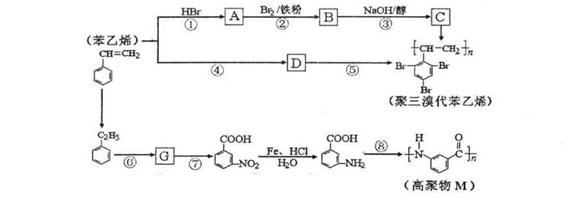
苯环上的取代反应有如下定位规律:当苯环上已经有了一个取代基时,新引入的取代基因受到原取代基的影响而取代其邻、对位、或间位的氢原子。使新取代基进入它的邻、对位的取代基有-R(烷基)、-NH2等;使新取代基进入它的间位的取代基有-COOH、-NO2等;
(1)D是高分子化合物,写出D的结构简式 。
(2)①②③④⑤反应中属于取代反应的是 ;反应⑧的类型为 。
(3)设计反应①、③的目的是 。
(4)写出下列反应的化学方程式(若有多种可能,只要求写出其中1个)
反应③: 。
反应⑦: 。
(5)G有多种同分异构体,写出任意一个符合下列条件的同分异构体的结构简式 。
①能发生银镜反应
②能与FeCl3溶液发生显色反应
③核磁共振谱氢图中出现6组吸收峰
27、(15分)乙二酸(HOOC-COOH)俗称草酸,分子式H2C2O4,是一种重要的有机化工原料。某学习小组对乙二酸的有关性质进行了探究,请你参与其中并回答有关问题·
I、探究乙二酸的热稳定性
通过查阅资料知道,乙二酸不稳定, 受热时易发生分解,相应的化学方程式为:
受热时易发生分解,相应的化学方程式为:
HOOC-COOH H2O+CO2↑+CO↑
学习小组拟用下图提供的仪器和试剂(可重复使用),设计一个实验,来证明乙二酸的受热分解产物中有CO2和CO(部分夹持仪器省略)

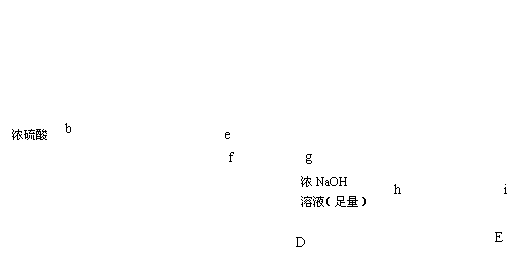
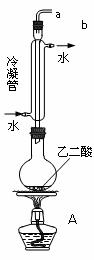
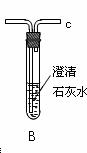
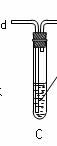
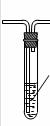

(1)用字母表示接口的正确连接顺序,括号可不填满,也可补充:
a→b→c→( )→( )→d→e→( )→( )→( )→( )→……
(2)证明分解产物中有CO的实验依据是 。
(3)指导老师认为同学们用上图提供的仪器和试剂做实验时,存在一些欠缺,请你帮忙指出来 。
II、探究乙二酸的还原性
准确称取Wg草酸晶体(H2C2O4·2 H2O),溶于水配成500mL溶液,取25.00mL置于锥形瓶中,用酸性高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。(已知:①MnO4-在酸性环境下的还原产物是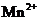 )
)
(4)滴定时发生反应的离子方程式为
(5)酸性高锰酸钾溶液的浓度为 mol·L-1
III、探究乙二酸和高锰酸钾溶液反应时的速率变化
学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,溶液褪色总是先慢后快。即反应速率由小变大。为此,同学们做了如下的对比实验:
|
药品 |
H2C2O4(aq) |
KMnO4(H+)(aq) |
MnSO4(S) (g) |
褪色时间 (S) |
||
|
C(mol·L-1) |
V(mL) |
C(mol·L-1) |
V(mL) |
|||
|
实验1 |
0.1 |
2 |
0.01 |
4 |
0 |
30 |
|
实验2 |
0.1 |
2 |
0.01 |
4 |
5 |
4 |
(6)同学们测出的褪色时间,是以下列哪个选项作为依据的 (填编号)。
A、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫红色为止。
B、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由无色变为紫红色为止。
C、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色为止。
(7)你认为溶液褪色先慢后快的原因是 。
26、(14分)化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I、氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图实验
(图中所用电极均为惰性电极)
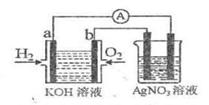 (1)对于氢氧燃料电池中,下列表达不正确的是
(1)对于氢氧燃料电池中,下列表达不正确的是
A、a电极是负极,OH-移向负极
B、b电极的电极反应为:O2+2H2O+4e-=4OH-
|
D、电池中电解质溶液的PH保持不变
E、氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)右图装置中盛有100mL 0.1mol·L-1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时右图装置中溶液的PH= 。(溶液体积变化忽略不计)
II、氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3(g) ;ΔH=-92.2KJ·mol-1
2NH3(g) ;ΔH=-92.2KJ·mol-1
(1)下列事实中,不能说明上述可逆反应已经达到平衡的是 。
①N2、H2、NH3的体积分数不再改变
②单位时间内生成2nmolNH3的同时生成3nmolH2
③单位时间内生成3nmolN-H键的同时生成nmolN≡N
④用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2.00L的密闭容器中进行,测得如下数据:
|
时间(h) 物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
|
N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
|
H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
|
NH3 |
0.00 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2小时时放出的热量为 KJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1
③此条件下该反应的化学平衡常数K= (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com