
32.(14分)(1) 、 (填名称)。(2) (填序号):
(3) ;
(4) ; 。
31.(18分)(1)①______反应; ②E1_____,E2______(填“增大”“减小”“不变”)
(2)① ② ③a= mol·L-1。
30.(16分)(1) ;
(2)(选择“>”、“<”、“=”填空):a b(3) ;
(4) I II III IV ;
(5)实验方案2:
实验方案3:
(6) 。
33.(16分)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
(1)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是: ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热 (填“大于”、“等于”或“小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则氢气燃烧热的热化学方程式为 。
(2)下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应是 。

英德中学2010届第三次周测理科综合化学答题卷
班级 座号 姓名 成绩
选择题(36分)
非选择题(64分)
32.(14分)有机物A是一种重要化工生产的中间体,其结构简式如下:
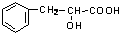 (1)A中含的官能团有:
、
(填名称)。
(1)A中含的官能团有:
、
(填名称)。
(2)A可能具有的化学性质有: (填序号):
①能与金属钠反应放出氢气;②能与在烧碱溶液中发生水解反应;③能与甲酸发生酯化反应;④能与Ag(NH3) 2OH溶液发生银镜反应。
(3)写出与乙醇发生酯化反应的方程式: ;
(4)在催化剂Pt的作用下,A与H2加成后的生成物的结构简式为 ;
A与浓硫酸混合加热发生消去反应,其产物的结构简式为 。
31.(18分)(1)反应A(g)+B(g) 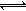 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
①该反应是_______________反应(填“吸热”“放热”);
②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_____,E2______(填“增大”“减小”“不变”);
(2)已知可逆反应:M(g)+N(g) P(g)+Q(g) △H>0,请回答下列问题:
P(g)+Q(g) △H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2 mol·L-1,a = mol·L-1。
30.(16分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方
案经老师批准后进行试验,实验现象记录如下表(实验方案4、5盐酸浓度因记
录表中数据模糊,分别用a、b表示):
|
实验方案 |
实验现象 |
|
1.用砂纸打磨后的镁条与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞试液的冷水反应 4.镁条与 a mol/L的盐酸反应 5.铝条与 b mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 |
I.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 II.放出无色气体,气体可燃,溶液变浅红色 III.反应不十分强烈,产生的气体可燃 IV.剧烈反应,产生的气体可燃 V.生成白色絮状沉淀,继而沉淀消失 VI.生成淡黄色沉淀 |
请根据记录回答下列问题:
(1)该同学的实验目的为 ;
(2)请比较a、b的大小关系(选择“>”、“<”、“=”填空):a b
(3)完成实验方案3除需要烧杯、小刀 、玻璃片、胶头滴管等外,还必须用到的一种仪器名称是 ;
(4)请根据记录表填写实验现象序号对应的实验方案编号:
I II III IV ;
(5)请分别写出下列实验方案中各现象对应的离子方程式:
实验方案2:
实验方案3:
(6)该实验结论是 。

23.下列化学实验事实及其解释都正确的是
A.向碘水中滴加CCl4振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
C.向0.1 mol·L-1 FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
D.向2.0mL浓度均为0.1 mol·L-1 KCl、KI溶液中滴加1~2滴0.1 mol·L-1的AgNO3溶液,振荡沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
22.下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.用浓盐酸与反应制取少量氯气: MnO2+2H++2Cl-=Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:
AlO2-+CO2+2H2O= Al(OH)3↓+HCO3-
D.氯化铁溶液与氨水反应制Fe(OH)3:Fe3++3NH3·H2O = Fe(OH)3↓+3NH4+
12.X、Y、Z、W均为短周期元素,它们在周期表中相对位置如右图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中错误的是
A.Y的气态氢化物的稳定性较Z的强
B.原子半径:W>Z>Y>X
C.最高价氧化物的水化物酸性W较Z强
D.四种元素的单质中,Z的熔沸点最高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com