
19.(12分)乙基香兰素是当今世界上最重要的合成香料之一,其结构简式如下图所示。
(1)以下推测正确的是 (填字母)。
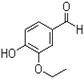 a.从分子结构上看,它应该属于芳香烃
a.从分子结构上看,它应该属于芳香烃
b.该物质的一个分子内含有一个碳氧双键、三个碳碳双键
c.1 mol该物质最多能与4molH2发生加成反应
d.该物质能与碳酸钠溶液反应产生CO2气体
(2) R物质属于乙基香兰素的同分异构体,其性质如下:
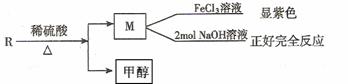
 试写出符合条件的R的同分异构体的结构简式(任写两种) :
;
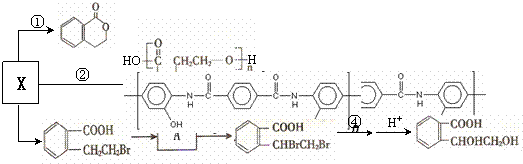
。(3)X也是乙基香兰素的同分异构体,可以通过不同的反应制得下列物质。
试写出符合条件的R的同分异构体的结构简式(任写两种) :
;
。(3)X也是乙基香兰素的同分异构体,可以通过不同的反应制得下列物质。
请回答下列问题:
(Ⅰ)反应①、②的反应类型 、 ;
(Ⅱ)反应③所需的试剂是 ;A的结构简式 ;
(Ⅲ)反应④的化学方程式 。
18.(10分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
 C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3
kJ•mol-1,ΔS=+133.7J•(K•mol)
-1
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3
kJ•mol-1,ΔS=+133.7J•(K•mol)
-1
①该反应能否自发进行与 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为 。
②该反应的逆反应为 (填“吸”或“放”)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是 (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
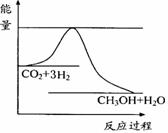 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器
中,充入1mol CO2和3mol H2,下列措施中能使
c (CH3OH)增大的是___________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
17.(10分)我国目前制备多晶硅主要采用三氯氢硅氢还原法、硅烷热解法和四氯化硅氢还
原法。由于三氯氢硅还原法具有一定优点,被广泛应用。其简化的工艺流程如图所示:
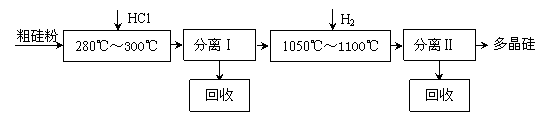
(1)制备三氯氢硅的反应为:Si(s)+3HCl(g) == SiHCl3(g)+H2(g) ΔH=-210 kJ•mol-1。
伴随的副反应有:Si(s)+4HCl(g) == SiCl4(g)+2H2(g) ΔH=-241 kJ•mol-1。
SiCl4在一定条件下与H2反应可转化为SiHCl3,反应的热化学方程式为:
SiCl4(g)+H2(g) == SiHCl3(g)+HCl(g) ΔH= 。
(2)由纯SiHCl3制备高纯硅的化学反应方程式为 。该生产工艺中可以循环使用的物质是 (至少写出两种)。
(3)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法。工业上广泛采用的合成硅烷方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,化学方程式是 ;整个制备过程必须严格控制无水,否则反应将不能生成硅烷,而是生成硅酸和氢气等,其化学方程式为 ;整个系统还必须与氧隔绝,其原因是 。
16.(8分)下列框图表示各有关物质之间的转化关系,所有反应物、生成物及溶液中的水均未标出。已知常温下D、E、F、H、L、N均为气体;A的焰色反应呈黄色;向B的溶液中滴加KSCN溶液,无明显现象;1molB隔绝空气分解得到F、G、H三种氧化物,其物质的量均为1mol;F是易与血红蛋白结合的物质;J是现代社会中应用最广泛的金属单质。
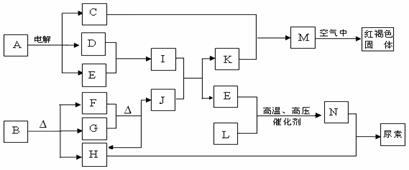
请回答下列题:
(1)B的化学式 ;H的电子式 。
(2)电解A溶液的离子方程式为 。
(3)D与E反应可制得一种重要的化工原料,其反应的现象是 。
(4)F与G反应的化学方程式为 。
15.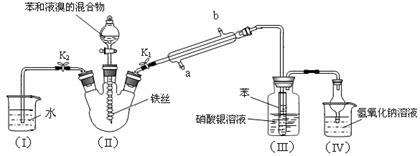 (10分)某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。
(10分)某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。
请回答下列问题:
(1)冷凝管所起的作用为冷凝回流和 ,冷凝水从 口进入(填“a”或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。III中小试管内苯的作用是 。
(3)能说明苯与液溴发生了取代反应的现象是 。
(4)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中。这样操作的目的是 ,简述这一操作的方法 。
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
① 用蒸馏水洗涤,振荡,分液;② 用5%的NaOH溶液洗涤,振荡,分液;
③ 用蒸馏水洗涤,振荡,分液;④ 加入无水CaCl2粉末干燥;
⑤ (填操作名称)。
14.在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。
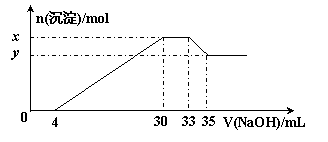 下列叙述正确的是
下列叙述正确的是
A.x与y的差值为0.01 mol
B.原溶液中c(Cl-)=0.75 mol·L-1
C.原溶液的pH=1
D.原溶液中n(Mg2+)∶n(Al3+)=5∶2
非 选 择 题
13.铅蓄电池在现代生活中有广泛应用,其电极材料是Pb和PbO2,电解液是硫酸溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
A.蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4
B.电解池的阳极反应式为:4OH-- 4e-==2H2O + O2↑
C.电解后,c(Na2SO4)不变,且溶液中有晶体析出
D.蓄电池中每生成1molH2O,电解池中就消耗1molH2O
12.下列溶液中各微粒的浓度关系正确的是
A.pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液:c (NH4+)大小顺序为①>②>③
B.pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
C.0.2mo1·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.0.2 mo1·L-1 HCl与0.1 mo1·L-1 NaAlO2溶液等体积混合:
c(Cl-)> c(Na+)>c(Al3+)>c(H+)>c(OH-)
11.下图是我国化学家近年来合成的两种聚乙炔衍生物分子的结构式。
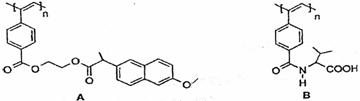
下列说法不正确的是
A.A和B均能在一定条件下水解,且水解均生成两种产物
B.A水解生成的高分子化合物的单体中所有碳原子共平面
C.B水解产生的氨基酸分子中有一个手性碳原子
D.A和B各1mol与热碱液反应,均最多消耗2n mol NaOH
10.下列离子方程式书写正确的是
A.足量澄清的石灰水与碳酸氢钙溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.用FeS除去工业废水中的Hg2+:Hg2++S2- =HgS↓
C.向Fe(OH)3中加入HI溶液:Fe(OH)3+3H+=Fe3++3H2O
D.向Ag(NH3)2OH溶液中加足量稀硝酸:Ag(NH3)2++ OH-+3H+=Ag++2NH4++H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com