
22、(12分)
(1) _____________, ______________。 (2)____ ____
(3)________________________, ____________
(4)___________、___________, _____________________________________________。
(5)___________, __________________________________________________________。
21、(8分)
(1) 。
(2) , ,
(3)
24、(7分)晶体硅是一种重要的非金属材料,在现代电子工业中具有非常重要的应用。工业上制备高纯硅的主要步骤如下:
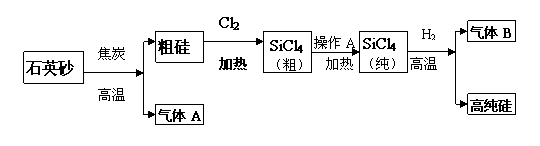

(1)下列有关硅及化合物的说法,正确的是__________。
A.石英的主要成分是SiO2
B.太阳能电池使用单质硅做材料,其应用有利于环保、节能
C.粗硅制备高纯硅的过程不涉及氧化还原反应
D.玻璃、水泥、陶瓷都属于硅酸盐产品
(2)SiCl4在室温下为无色液体,易挥发,粗硅与氯气反应得到的粗SiCl4中含有大量固体杂质,通过“操作A”提纯得到纯SiCl4,操作A的名称是___________。
(3)整个制备过程必须严格控制无水无氧。H2还原SiCl4过程中发生的反应是:
在该过程中若有O2混入,可能引起的后果是___________________________。


2009-2010学年度第二学期期中考试五校联考
高一化学(理科)
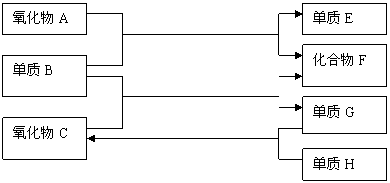
23、(8分)已知CO和H2的混合气体称为水煤气,可由碳(C )与水蒸气(H2O)在高温下反应生成。如下图:
高温
反应①

 高温
高温
反应②
燃烧
反应③
已知:单质E可作为半导体材料,化合物F是有毒的氧化物,C为液态。据此,请填空:
(1)氧化物A是
(2)化合物F是
(3)反应①的化学方程式是
(4)反应②的化学方程式是
(5)反应③的化学方程式是
22、(12分)下表列出了A-I九种元素在周期表中的位置:
|
主族 周期 |
IA |
IIA |
|
|
|
|
|
0 |
|
2 |
|
|
|
E |
|
F |
G |
|
|
3 |
A |
C |
D |
|
|
|
H |
I |
|
4 |
B |
|
|
|
|
|
|
|
(1)这九种元素中,金属性最强的元素是_____(填元素符号,下同),化学性质最不活泼的元素是______。
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是____ ___(填化学式)
(3)A、B、C、D按照原子原子半径由大到小的顺序排列为__________________(用元素符号排序)。A与G可形成电子层结构相同的离子,这两种离子的半径由大到小排列为____________(填化学式)。
(4)F元素的氢化物有______、_______,其中一种能与B的单质发生反应,请写出该反应的离子方程式________________________________。
(5)这九种元素之间可以形成多种简单离子化合物和共价化合物,请写出其中一种的化学式__________,并用电子式表示其形成过程:____________________________________。
21、(8分) 实验室用下列有关装置先制取干燥、纯净的Cl2并进行漂白性性质实验,试根
据下列装置回答有关问题。
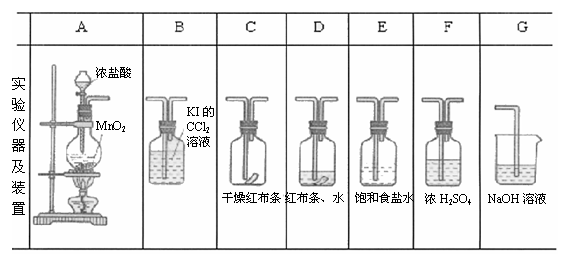
(1)上述装置中各仪器从左至右的连接顺序是 。
(2)E装置目的是 ,D装置是为了 ,
(3)分别写出A、G中的化学反应原理
20、碲(Te)是第52号元素,位于周期表中第VIA族,处于金属区与非金属区的交界线上。下列叙述正确的是( )
A. 碲的单质具有半导体的性能 B. 碲化氢(H2Te)比H2S更稳定
C. 碲可在空气中燃烧生成二氧化碲(TeO2) D. H2TeO4的酸性比H2SO4强
19、由分别与Ne和Ar原子具有相同的电子层结构的离子所形成的化合物是( )
A. CaO B. MgBr2 C. NaF D. NaCl
18、下列化学反应的离子方程式正确的是
A.向FeCl3溶液中加人Cu粉:2Fe3++Cu=2Fe2++Cu2+
B.向酸性碘化钾溶液中滴人双氧水:2I-+2H++H2O2=I2+2H2O
C.NaOH溶液中通入过量二氧化硫:SO2+2OHˉ=SO32-+H2O
D.碳酸氢钙溶液和氢氧化钠溶液混合:HCO3-+OHˉ=CO32-+H2O
17、下列制备和收集气体的实验装置合理的是( )
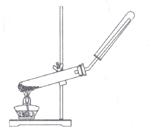
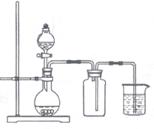
A.用氯化铵和氢氧化钙制NH3 B.用铜片和硝酸制NO2
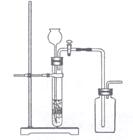
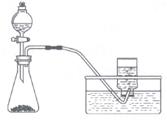
C.用石灰石与稀盐酸制CO2 D.用过氧化氢与二氧化锰制O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com