
4. 物质的量相等的两种气体,必然
A.体积相同 B.质量相等 C.原子数相同 D.分子数相同
3.下列叙述中正确的是
A. 单质只能用置换反应制取 B.由一种元素组成的物质一定是单质
C. 纯碱从物质的分类看不属于碱 D.金属氧化物称为碱性氧化物
 1.原子结构模型的演变图中,(1)为道尔顿实心球式原子模型、(2)为卢瑟福带核的原子模型、(3)为汤姆生葡萄干面包式原子模型、(4)为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是
1.原子结构模型的演变图中,(1)为道尔顿实心球式原子模型、(2)为卢瑟福带核的原子模型、(3)为汤姆生葡萄干面包式原子模型、(4)为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是
A.(1)(3)(2)(4)
B.(1)(2)(3)(4)
C.(1)(4)(3)(2)
D.(1)(3)(4)(2)
2.下列说法中,正确的是
A.氢气在氯气中燃烧发出蓝色火焰 B. 光照氯水有气泡冒出,该气体是氯气
C.燃烧反应一定要有氧气参加 D.饱和氯水长期放置,颜色逐渐变浅
25.(共16分)
(1) A D B (2分)
(2) A装置中白色粉末变蓝色; (2分)
装置D中澄清石灰水不变浑浊, (1分)
装置B中黑色粉末变为红色固体, (1分)
装置E中澄清石灰水变浑浊 (1分)
(3)在装置A与D之间加一个装有一定量水(或乙醇)的洗气瓶 (2分)
(4) 取少量红色固体于试管中, (1分)
滴加稀硫酸后,红色固体有部分溶解,溶液变蓝色, (1分)
说明红色固体中含有Cu2O。 (1分)
(5)0.2 mol (2分)
(6) (2分)
(2分)
25.(16分)某化学兴趣小组的同学,欲通过实验验证无水乙二酸(H2C2O4)受热分解产物为CO2、CO、H2O,设计了一套如下图所示的实验装置。
(已知:①乙二酸熔点100.1 ℃,157.0 ℃升华,175.0 ℃受热分解; ②能溶于水和乙醇;③H2C2O4 + Ca(OH)2 = CaC2O4↓ + 2 H2O)
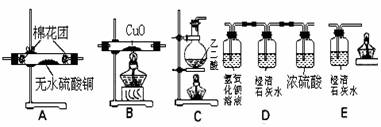
请回答:
(1)各装置的连接顺序为:C → → → → E。
(2)装置中能证明分解产物中有H2O的现象是 ;
证明分解产物中有CO的现象
。
(3)本实验方案有不妥之处,请叙述改进的方案
。
(4)已知 Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝酸、稀硫酸和稀硝酸四种试剂。简述如何用最简便的实验方法来检验CuO经CO还原所得到的红色产物中是否含有Cu2O。
。
(5)将10.0 g CuO在高温下通入CO使固体部分还原,反应结束后测得剩余固体质量为8.4 g,则反应过程中转移电子的物质的量为 。
(6)a g CuO和Cu2O的混合物,加入2 mol/L H2SO4 V mL,恰好使混合物全部反应,则V的取值范围为 。
28、(本题共10分,每空2分)
(1)Cl2>Br2>I2 (2)3Fe+4H2O Fe3O4+4H2;CO+H2O
Fe3O4+4H2;CO+H2O CO2+H2
CO2+H2
(3)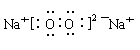 ;2Na2O2+2H2O=4Na++4OH-+O2↑
;2Na2O2+2H2O=4Na++4OH-+O2↑
在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)  2C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中体积分数为n% 。
2C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中体积分数为n% 。
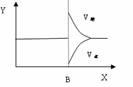
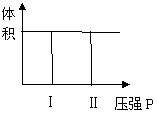 (1)若把2molA和1molB充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ(如下图),则该反应的正反应是 反应(填:吸热;放热)
(1)若把2molA和1molB充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ(如下图),则该反应的正反应是 反应(填:吸热;放热)
(2)若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是: 。
(3)若将原容器改为容积可变的容器,在一定温度和常压下,将2molA和1molB充入该容器中,建立平衡之后,B的物质的量浓度为a mol/L。
Ⅰ、现持续增大压强,当:
①当压强为原来1.5倍时,B的平衡时物质的量浓度为m mol/L,测得m<1.5a;
②当压强为原来10倍时,B的平衡时物质的量浓度为n mol/L,测得n >10 a;
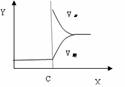
试解释形成第②种结果的可能原因: 。
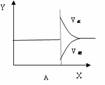
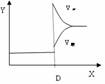
Ⅱ、再将2molA和1molB充入该容器中,则反应速率(Y)与时间(X)关系图象可表示为___。
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
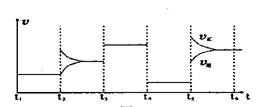
(4)下图为t2时刻后在原平衡的基础上改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接)
(5)若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol。则D的起始物质的量n(D) 应满足的条件是 ,(用含有W的代数式表示)
答案..①放热反应
②M(D)=原平衡状态的相对分子质量
③I A转化为非气态,增大压强,平衡左移
Ⅱ A
④K1=K2=K3=K4>K5
⑤n(D)=(2-W)/2
28、 (10分)A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均己给出。
(10分)A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均己给出。
(1)若反应①、②、③均为溶液中的置换反应,A、D、E为第ⅦA族元素单质。则A、D、E的氧化性由强到弱的顺序为(用化学式表示)________________________。
(2)若B是某元素R的氢化物,B的沸点大于与R同主族的其他元素氢化物的沸点,且B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。则反应①的化学方程式_______________________________,③的化学方程式__________________________。
(3)若B由短周期元素X、Y组成,且X、Y原子个数比为1∶1,B晶体中既含离子键,又含非极性共价键;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为_________________,反应①的离子方程式________________________。
27、(本题共11分,每空1分)
(1)氢;氯 (2) 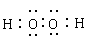 ;H2O2+SO2=H2SO4
;H2O2+SO2=H2SO4
(3)2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6 kJ/mol;
2SO3(g);ΔH=-196.6 kJ/mol;
接触室;常压、400~500℃、催化剂
(4)用湿润的KI淀粉试纸接近阳极产物,试纸变蓝;
Cl2+2OH- =Cl-+ClO-+H2O;阴;阳
27、(11分)有A、B、C、D、E五种元素,原子序数依次增大,位于不同的三个短周期,其中B与D为同一主族元素,它们可形成化合物DB2、DB3,在同周期元素中,C的金属性最强,E的非金属性最强;请回答:
(1)写出A、E三种元素的名称:A____________,E_____________。
(2)A、B形成的原子个数比为1∶1的化合物的电子式为__________________,该化合物与DB2化合生成一种强酸的化学方程式为:__________________________。
(3)已知在一定条件下1 mol DB2完全转化为气态DB3,放出98.3 kJ的热量。该反应的热化学方程式是____________________________________________,工业上进行这一反应的设备是_____________,反应的适宜条件为________________________。
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为______________________________________________________________________;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是_____________________________。工业实际中常采用阳离子交换膜电解槽进行电解,若某一电极由碳钢网制成,则该电极为电解槽的___________(填“阴”或“阳”,下同)极,精制的由C、E形成的化合物的饱和溶液进入_________极室.
18.在100mL含等物质的量HBr和H2SO3的溶液中通入0.1mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3),原溶液中HBr和H2SO3的浓度都等于
A.1.0 mol·L-1 B.0.4 mol·L-1 C.0.75 mol·L-1 D.0.8 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com