
9.(江苏省泗阳中学2009届高三第一次摸底考试)有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、 、SO
、SO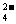 、
、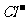 、
、 、
、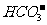 ,取该溶液实验如下:
,取该溶液实验如下:
|
实验步骤 |
实验现象 |
|
①取少量该溶液,加几滴甲基橙 |
溶液变红色 |
|
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,后在空气中又变成红棕色 |
|
③取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
|
④取③中上层清液,加AgNO3溶液 |
有白色沉淀生成,且不溶于HNO3 |
|
⑤取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)为进一步确定其他离子,应该补充的实验是________ _ ________
。
答案:(7分)(1)Mg2+、Al3+、NO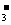 、SO
、SO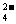
(2)Fe2+、Ba2+、 、HCO
、HCO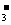
(3)焰色反应,取少量原溶液,加入Ba(NO3)2溶液后,取上层清液加入AgNO3溶液和稀HNO3
8.对下列各组离子的叙述不正确的是 ( )
A.H+、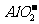 、Ba2+、
、Ba2+、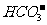 不能在水中大量共存
不能在水中大量共存
B.Mg2+、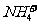 、Fe2+、
、Fe2+、 能在酸性溶液中大量共存
能在酸性溶液中大量共存
C.Fe3+、K+、 、
、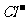 能大量共存且使溶液显红色
能大量共存且使溶液显红色
D.Na+、 、
、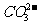 、
、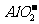 能在碱性溶液中大量共存
能在碱性溶液中大量共存
答案:BC
7.常温下测得某无色溶液中由水电离出的H+浓度为1×10-13mol/L,又知该溶液中还有 、Na+、
、Na+、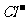 ,那么该溶液中还一定存在的离子是
(
)
,那么该溶液中还一定存在的离子是
(
)
A.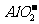 、
、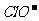 B.Mg2+、、
B.Mg2+、、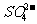 C.Fe2+ 、Cu2+ D.Ba2+、K+
C.Fe2+ 、Cu2+ D.Ba2+、K+
[答案]D
6.在pH=0的无色透明溶液中,因发生氧化还原反应而不能大量共存的离子组是 ( )
A.Na+、K+、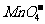 、
、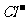 B.
B.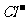 、
、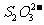 、K+、Na+
、K+、Na+
C.Na+、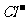 、
、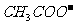 、K+ D.K+、
、K+ D.K+、 、Na+、
、Na+、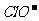
[答案]BD
5.某能使石蕊试液变红的溶液中,能大量存在的离子是 ( )
A.Al3+ 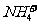
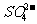
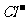 B.Na+ Mg2+
B.Na+ Mg2+ 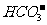

C.K+ Na+ 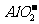
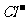 D.Fe2+ K+ NO3-
D.Fe2+ K+ NO3- 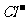
[答案]A
4. 下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是 ( )
A. Fe3+、CI-、Na+、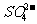 B. Al3+、Na+、
B. Al3+、Na+、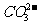 、
、
C. Ag+、Na+、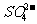 、
、 D. AlO2-、
D. AlO2-、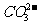 、K+、Na+
、K+、Na+
[答案]B
3. 某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、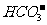 、
、 B.Na+、
B.Na+、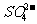 、
、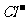 、
、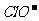
C.H+、Mg2+、SO42-、 - D.Ag+、K+、
- D.Ag+、K+、 、Na+
、Na+
[答案]B
2. 若溶液中由水电离产生的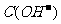 =1×10-14mol·L-1,此溶液中一定可以大量共存的离子组是
( )
=1×10-14mol·L-1,此溶液中一定可以大量共存的离子组是
( )
A. Al3+ 、Na+ 、 、
、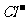 B. K+ 、Na+、
B. K+ 、Na+、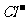 、
、
C. K+ 、Na+ 、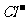 、
、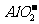 D. K+ 、 NH4+、
D. K+ 、 NH4+、 、
、
[答案]B
1.下列化学反应的离子方程式正确的是 ( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3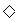 +2HClO
+2HClO
C.利用腐蚀法制作印刷线路板:Fe3+ + Cu == Fe2+ + Cu2+
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++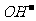 +H++SO
+H++SO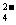 =CaSO4
=CaSO4 +H2O
+H2O
E.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
F.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH
+ 2
2C6H5OH
+ 2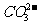
G.钠与水的反应:Na+H2O=Na++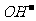 +H2↑
+H2↑
H.氯气与水反应:Cl2+H2O=2H++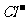 +
+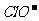
I.石灰乳与Na2CO3溶液混合:Ca2++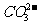 =CaCO3
=CaCO3
J.NH4HSO3溶液与足量的NaOH溶液混合加热:
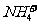 +
+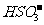 +2
+2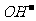
 NH3Ÿ+
NH3Ÿ+ +2H2O
+2H2O
K.硫酸铜与烧碱反应:CuSO4+2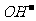 ===Cu(OH)2↓+
===Cu(OH)2↓+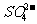
L.苯酚与碳酸钠反应:2C6H5OH+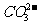 ===2C6H5O-+CO2↑+H2O
===2C6H5O-+CO2↑+H2O
M.碳酸钡与硫酸反应:Ba2++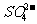 ===BaSO4↓
===BaSO4↓
N.足量的硫酸铝与纯碱反应:2Al3++3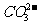 +3H2O===2Al(OH)3↓+3CO2↑
+3H2O===2Al(OH)3↓+3CO2↑
[答案]J、N
17. 某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜21世纪教育网
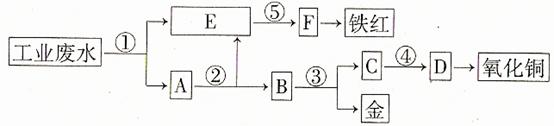
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
[答案](1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+
Cu2++Fe=Cu+Fe2+ 2Au +3Fe=2Au+3Fe2+
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
[解析]首先用过量铁屑将H+、Fe3+、Cu2+、Au3+等离子还原成H2、Fe2+、Cu、Au,发生4个反应,E中应为Fe2+,因为后面生成铁红,故⑤为碱液氢氧化钠,试剂②是将过量铁屑溶解,试剂③是将Cu、Au分离应为稀硝酸,从C中的Cu2+到氧化铜,也应为碱液氢氧化钠。
[考点分析]有关离子反应的综合运用21世纪教育网
[专题突破]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com