
1.化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A.检验溶液中是否含有SO32-,所用BaCl2溶液用HNO3酸化
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe2+时,用硝酸酸化
D.检验溶液中是否含有SO42-时,在无其它阳离子干扰的条件下,用盐酸酸化的BaCl2溶液
18.2005年末,笔记本电脑价格再次大跳水,有超长继航能力的电池笔记本更受用户欢迎。甲醇燃料电池的笔记本就是其中的一种。其工作原理是甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。下列说法中正确的是 ( )
A.左边的电极为电池的正极,a处通入的是甲醇
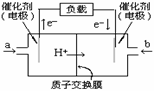 B.右边的电极为电池的负极,b处通入的是空气
B.右边的电极为电池的负极,b处通入的是空气
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+
D.电池的正极反应式为:O2+2H2O+4e-=4OH-
17.在热的稀硫酸溶液中溶解了10.16g FeCl2。当加入50mL 0.4mo1·L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,NO3-也完全反应,并有NOX气体逸出。则该 NOx是
A.N2O B.NO C.N2O3 D.NO2
16.碘元素有多种价态,可以形成多种含氧阴离子IxOyn-。由2个IO62-正八面体共用一个面形成的IxOyn-的化学式为 ( )
A.I2O94- B.I2O106- C.I2O118- D.I2O1210-
15.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是 ( )
A.pH>7,且 c(OH-) > c(Na+) > c(H+) > c(CH3COO-)
B.pH>7,且 c(Na+) + c(H+) = c(CH3COO-) + c(OH-)
C.pH<7,且c(CH3COO-) > c(H+) >c(Na+)> c(OH-)
D.pH=7,且c(CH3COO-) > c(Na+) >c(H+) = c(OH-)
14.在pH=1的溶液中,可以大量共存的离子是 ( )
A.K+、Na+、SO42-、S2O32- B.NH4+、Mg2+、SO42-、Cl-
C.Na+、K+、HCO3-、Cl- D.K+、Na+、AlO2-、NO3-
13. 已知在一定条件下2SO2+O2 2SO3 ;△H = Q KJ/mol。向一密闭容器中加入2mol SO2
和1mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1; 另一相同容器中加入2 mol SO3,在相同条件下,达平衡后吸收的热量为Q2,
则下列关系正确的是
已知在一定条件下2SO2+O2 2SO3 ;△H = Q KJ/mol。向一密闭容器中加入2mol SO2
和1mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1; 另一相同容器中加入2 mol SO3,在相同条件下,达平衡后吸收的热量为Q2,
则下列关系正确的是
( )
A.Q>Q1>Q2 B.Q1>Q2>Q C.Q1>Q>Q2 D.Q1 = Q2>Q
12.能正确表示下列化学反应的离子方程式是 ( )
A.纯碱溶液中通入足量CO2:CO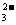 + H2O + CO2
+ H2O + CO2 2HCO3-
B.苯酚钠溶液中加入氯化铝溶液:
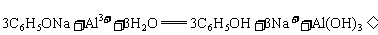
C.碳酸钙跟醋酸反应:
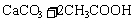

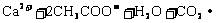
D.碳酸镁溶于硝酸中: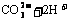

11.用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.常温常压下,16gO2和O3的混合物所含分子数为0.5NA
B.1mol CH3+(碳正离子)中含有电子数为8NA
C.常温常压下,31g白磷与红磷混合物,含有NA个磷原子
D.1L 0.1mol·L-1的FeCl3溶液中含Fe3+为0.1NA
10.咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为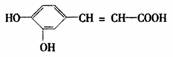 .下列关于它的性质的说法正确的是
( )
.下列关于它的性质的说法正确的是
( )
A.咖啡酸只能与醇类物质发生酯化反应
B.1 mol咖啡酸能与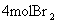 发生反应
发生反应
C.1 mol咖啡酸跟500 mL 2 mol 的NaOH溶液恰好完全反应
的NaOH溶液恰好完全反应
D.咖啡酸能使酸性 溶液褪色,但不能与
溶液褪色,但不能与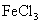 溶液发生显色反应
溶液发生显色反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com