
20.某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如右表所示,请回答:
(1)三次检测结果中第__________次检测结果明显不正确。
(2)在检测时,为了确定溶液中是否存在SO42-离子、CO32-离子和Cl-离子:
首先,向溶液中滴加___ __溶液(填化学式),其目的是 ;
其次,再继续加入过量的该溶液,其目的是 ;
第三,上述反应结束后,向溶液中再加入 溶液(填化学式),其目的是 ;
第四,过滤,再向滤液中加入_________溶液(填化学式),其目的是 。
19.将3.22 g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为 g。
18.(1)在标准状况下,100 mL某气体X的质量是0.179 g,则这种气体X的相对分子质量是___ ___。(保留整数)
(2)在同温同压下,某气体X对CH4的相对密度为2,则气体X的分子式可能为_________。
(3)下列给出的条件中,无法确定该物质摩尔质量的是 ______。
A.已知气体在标准状况时的密度 B.已知物质的体积和质量
C.已知物质的质量和物质的量 D.已知物质一个分子的实际质量
|
检测次数 |
溶液中检测出的物质 |
|
第一次 |
KCl、K2SO4、Na2CO3、NaCl |
|
第二次 |
KCl、BaCl2、Na2SO4、K2CO3 |
|
第三次 |
Na2SO4、KCl、K2CO3、NaCl |
17.(1)将质量比为14︰15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为_______,该混合气体的平均摩尔质量为___________。
(2) 5molCO2的质量是_________;在标准状况下所占的体积约为__________;所含的分子数目约为____________________;所含氧原子的数目约为___________________。
(3)4.5 g水与 g硫酸所含的分子数相等,它们所含氧原子数之比是 ,其中氢原子数之比是 。
(4)12.4 g Na2X中含有0.4 mol Na+,则Na2X的摩尔质量是 ,X的相对原子质量是 ,该物质的化学式为 。
16.同温同压下,等质量的O2和CO2相比较,下列叙述正确的是
A.体积比为8︰1 B.分子个数之比为11︰12
C.物质的量之比为11︰8 D.原子个数之比为12︰11
第Ⅱ卷(非选择题,共52分)
15.今有下列仪器:铁架台、铁圈、铁夹、三脚架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、坩埚钳、火柴、滤纸,从缺乏必要的仪器和用品的角度考虑,不能进行的分离操作是
A.蒸发 B.萃取 C.过滤 D.蒸馏
14.同温、同压下,某瓶充满O2时重116 g,充满CO2时重122 g,充满某气体时重114 g,则某气体可能是
A.H2S B.N2 C.HCl D.SO2
13.某溶液中含有较大量的Cl-、CO32-、OH-3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液; ②过滤; ③滴加AgNO3溶液; ④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②①
12.如果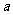 g某气体中含有的分子数为
g某气体中含有的分子数为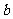 ,则
,则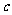 g该气体在标准状况下占有的体积应表示为(式中
g该气体在标准状况下占有的体积应表示为(式中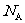 为阿伏加德罗常数的数值)
为阿伏加德罗常数的数值)
A.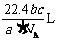 B.
B.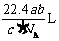 C.
C.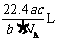 D.
D.
11.在标准状况下①6.72 L CH4 ②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3, 下列对这四种气体的关系从大到小表达正确的是: a.体积②>③>①>④ b.密度②>③>④>① c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.abcd D.cba
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com