
1.用NA代表阿伏加德罗常数的值,下列有关说法正确的是
A.78g过氧化钠晶体中,含2NA个阴离子
B.常温常压下,22.4L氦气含有NA个氦原子
C.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA
D.常温下16g O2与O3的混合气体中含氧原子数为NA
4.易忽视的化学反应中存在隐含反应后微粒数目
表达1.标准状况下,44.8L的NO与22.4L 的O2混合后,分子数为2NA
表达2.1L0.1mol/L Na2CO3溶液中含有的CO32-数目小于0.1NA
易混淆原因:忽视的化学反应中存在隐含反应
分析:表达1主要忽略NO2向N2O4的转化,使分子数减少,所以表达1错;表达2中主要忽略CO32-的水解,所以表达2错。
3.溶液中溶质为电解质(强、弱电解质)和非电解质的微粒数目
表达1.1L0.1mol/L的醋酸溶液中含醋酸分子数目为0.1NA
表达2.1L0.1mol/L的醋酸溶液中含分子数目小于0.1NA
表达3.0.1mol/L的醋酸溶液中含醋酸分子数目小于0.1NA
表达4.1L0.1mol/L的蔗糖溶液中含蔗糖分子数目为0.1NA
易混淆原因:均考查溶液中分子数目
分析:表达1中主要忽略了醋酸分子在水溶液中的电离;所以表达1错;表达2中主要忽略了醋酸溶液中的溶剂分子,所以表达2错;表达3中学生主要易忽略溶液的体积,习惯于考虑1 L计算;表达4中主要考查蔗糖是非电解质,在水中不发生电离,所以表达4正确。
2.盐在溶液中、熔融状态下、晶体中微粒数目
表达1.1L0.1mol/L NaHCO3溶液中含有的阴离子数目小于0.1NA
表达2.1molNaHSO4融化时含有阴离子数目为2NA
表达3.1molNaHSO4晶体中含有阴离子数目为2NA
易混淆原因:均考查盐在不同状态下的电离和水解的情况
分析:表达1中主要忽略了HCO3-在水溶液中的电离和水解知识,所以表达1错;表达2、3中主要忽略了HSO4-在融化状态和固态时不发生电离,所以表达2和3均错。
1.金属与浓硫酸的反应中有关电子转移数目
表达1.足量的Zn与含有2mol硫酸的浓硫酸反应,转移的电子数为2NA
表达2.1molZn与一定量的浓硫酸恰好完全反应,转移的电子数为2NA
表达3.一定量的Zn与一定量的浓硫酸恰好完全反应,生成标准状况下气体22.4L,转移的电子数为2NA
易混淆原因:均考查金属Zn与浓硫酸的反应,表达上又有一定的相似之处;
分析:表达1中要考虑随着反应的进行,浓硫酸浓度要变稀,生成的气体从SO2变为H2,所以转移的电子数在2NA-4NA之间,所以表达1错;表达2中只要考虑1molZn转移的电子数即可,不需考虑随着反应的进行,浓硫酸浓度变稀的情况,所以表达2正确;表达3中生成的气体为SO2和H2的混合气体,但无论是生成1mol SO2 或1mol H2,还是1mol两者的混合物,均转移电子数为2NA,所以表达3正确。
涉及阿伏伽德罗常数的问题每年高考都会考查,重现率很高,从近两年的考题来看,主要热衷考查学生的分析能力,如通过氧化还原反应考查电子转移数目、盐类水解、弱电解质的电离等,当然物质的状态对NA计算的影响仍然是考试的的热点。
解题思路:在正确理解有关概念的基础上,将题给物理量如质量、气体的体积、溶液的浓度等转化为指定微粒的物质的量,然后进行判断。
阿伏加德罗常数考查的主要方向:
(1)一定质量的物质中所含原子数、电子数,其中考查较多的是H2O、N2、O2、H2、NH3、P4等。
近两年考查热点除了单一物质的相关计算外,对于具有相同最简式的物质的混合计算也是一大热点,如08年广东卷考查了NO2和N2O4混合物中原子总数,09年江苏卷考察了乙烯和丁烯的混合气体中碳原子数,09年广东卷考查了乙烯和环丙烷(C3H6 )的混合物中的氢原子数。
注意点:a. 具有相同最简式的物质的混合计算可以将混合物看成一种物质进行相关计算;
b.要注意所给物理量是质量时与条件无关。
(2)一定体积的物质中所含原子数、分子数,曾考过的物质有Cl2、NH3、CH4、O2、N2、CCl4、C8H10等。
近两年考查热点是关于一定体积的气体混合后考查微粒的数目,如08年海南卷考查标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数;09年浙江卷考查标准状况下,5.6 L NO和5.6 L O2混合后的分子总数。
注意点:a.关于一定体积的气体混合后考查微粒的数目,要注意是否反应,反应后体积的变化;
b.当所给物理量是体积时要注意状况和状态。
(3)一定量的物质在化学反应中的电子转移数目,如Na2O2+H2O(或CO2),C12+NaOH、电解AgNO3溶液等
近两年考查的热点都是课本中的常见反应,如08年广东卷考查了1molCl2与足量Fe反应、1.5 mol NO2与足量H2O反应,08年江苏卷考考查了常温常压下的33.6L氯气与27g铝充分反应,08年上海卷考查了Na在氧气中完全燃烧,08年山东卷考查了H2O2+ Cl2=2HCl + O2反应中,每生成32g 氧气,则转移的电子数,08年海南卷考查了铝跟氢氧化钠溶液反应。而09年江苏卷和广东卷不约而同的考查了氯气与足量氢氧化钠溶液的反应。
注意点:a.要能准确写出化学反应方程式;
b.要注意反应物之间量的关系,注意进行过量计算;
c.要注意反应是否完全即注意反应的可逆性。
(4)一定体积和一定物质的量浓度溶液中所含电解质离子数、分子数,如稀硫酸、硝酸?镁等。
近两年的考试热点集中在考查电解质与非电解质的判断、考虑电解质是否水解或电离程度大小等。如08年山东卷考查了不同浓度下NH4+的水解程度的大小问题(一定温度下,1 L0.50mol·-1NH4Cl 溶液与2L0.25mol·-1NH4Cl 溶液含NH4+物质的量不同)、08年广东卷考查了硫酸的元数与硫酸的关系(1L1mol·L-1的硫酸溶液所含的H+数)、08年上海卷考查了Mg2+的水解(1L2mol·L-1的MgCl2溶液中含Mg2+数为2NA)、08年江苏卷考查了CO32-的水解(1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-),而09年江苏卷考查了从pH进行计算微粒数(25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA)、09年广东卷考查Fe3+的水解(将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA Fe3+)、09年福建卷考查了弱电解质乙酸的电离(1L0.1mol·L-1乙酸溶液中H+数为0.1NA)、09年浙江卷考查了CO32-的水解(在1 L 0.1 mol/L碳酸钠溶液中阴离总数大于0.1 NA)。
注意点:a.要注意是否水解或弱电解质的部分电离问题;
b.要注意从题给物理量能否求算出物质的量,如有时只给了物质的量浓度,未给体积,所以无法完成相应计算。
(5)某些典型物质中化学键数目,如SiO2、Si、金刚石、CH4、P4、CO2等。
近两年的考试热点简单有机物中化学键的数目判断,如08年江苏卷考查了己烷、09年浙江卷考查了乙烷。
注意点:a.要注意某些特殊物质中某些特殊的化学键的存在,如苯分子中不存在碳碳双键;
b.要注意化学键的计算方法-均摊法。
(6)细微知识点(易出错):状态问题,水、CCl4、C8H10等在标准状况下为液体或固体, SO3在标准状况下为固态、常温常压下为液态,戊烷及碳原子数更多的烃,在标准状况下为液态或固态。;D2O、T2O、18O2等物质的摩尔质量;Ne、O3、白磷等物质分子中原子个数等。
从近两年的试题来看涉及状态问题的较多,其他方面涉及较少,如08年涉及到的物质有苯、四氯化碳、SO3、己烷等;09年涉及甲醇、乙醇等。但特别提醒的是09年浙江卷出现的从晶体类型判断有无分子存在进而判断数目的问题值得关注(58.5 g氯化钠固体中含有NA个氯化钠分子)。
注意点:a.某些常见物质的状态与标准状况的关系是考查的热点;
b.注意分子数和原子数之间的关系;
c.注意同位素原子对常见物质的摩尔质量的影响。
2. 解读:常以选择题形式考查物质的量计算的微粒数、摩尔质量的数值、22.4mol/L的应用条件以及NA的数值等。
1. 考试说明:了解阿伏伽德罗常数的含义,并能进行有关计算。
19.求函数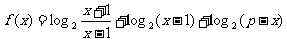 的定义域和值域.
的定义域和值域.
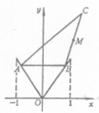 20.如图,函数
20.如图,函数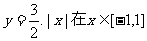 的图象上有两点A,B,AB//Ox轴,点M(1,m)(m是已知实数,且
的图象上有两点A,B,AB//Ox轴,点M(1,m)(m是已知实数,且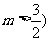 是△ABC的BC边的中点.
是△ABC的BC边的中点.
(Ⅰ)写出用B点横坐标t表示△ABC面积S的函数解析式S=f(t);
(Ⅱ)求函数S=f(t)的最大值,并求出相应的C点坐标.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com