
①既自以心为形役 ②置杯焉则胶
③之二虫又何知 ④寻蒙国恩,除臣洗马
①策扶老以流憩 ②时运不齐,命途多舛
③善万物之得时 ④本图宦达,不矜名节
⑤三餐而反,腹犹果然 ⑥伶仃孤苦,至于成立
① ,抚孤松而盘桓。②木欣欣以向荣, 。
③ ,或植杖而耘耔。④潦水尽而寒潭清, 。
⑤ ,川泽纡其骇瞩。⑥ ,秋水共长天一色。
⑦外无期功强近之亲, 。
⑧母、孙二人,更相为命, 。
25.(8分)将2 wg某铁、铝混合粉末平均分为两份,一份与足量盐酸反应,生成气体的体积为V1;另一份与足量NaOH溶液反应,生成气体的体积为V2(气体体积均在标准状况下测定)。
(1)若w=13.9,V1与V2之和为11.2 L, 混合物中铁和铝的物质的量之比为多少?
混合物中铁和铝的物质的量之比为多少?
(2)若铁、铝按不同的比例混合进行上述实验时,所生成的气体总体积仍为11.2 L,则w的取值范围?
24.(14分)下图是用浓H2SO4和HCOOH制备CO还原Fe2O3并检验反应产物的实验装置图。
|
|
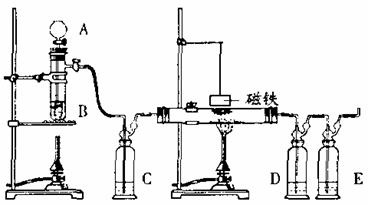
(1) A、B、C、E中应分别盛放 、 、 、 ;
(2) 制备CO的方程式为 ;
(3) 加热还原Fc2O3之前首先要做 检验;然后还要做 试验;
(4) 实验时应先点燃煤气灯 (填a或b)
(5) 磁铁要在反应 (填“前”或“后”)才能吊在玻璃管上方,它的作用是 ;
(6) D中所放物质为CuCl-NH3溶液,它的作用是 。
23.(14分)五种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
T |
X |
Y |
Z |
W |
|
性质 结构 信息 |
原子核外s电子总数等于p电子总数;人体内含量最多的元素。 |
其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
原子核外有五种不同能量的电子,且最外层有2个未成对电子 |
(1) 写出元素T的离子结构示意图 ;写出元素X的气态氢化物的电子式
;写出Z元素原子的核外电子排布式: ;元素Y的原子核外共有______种形状不同的原子轨道。
(2) Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式
。
(3) 对W元素的单质或化合物描述一定正确的是________________。
a.单质不溶于任何溶剂 b.其最高价氧化物的水化物为弱酸
c.其最高价氧化物的晶体为分子晶体 d.气态氢化物不稳定
(4) 上述元素中电负性最大的是
(用元素符号表示),若W能形成简单离子则五种元素所形成的简单离子中半径最大的是
(用离子符号 表示)。
表示)。
22.(11分) (1) 指出在使用下列仪器 (已净)或用品的第一步操作:
|
石蕊试纸检验气体 |
容量瓶 |
集气瓶收集氯化氢 |
|
|
|
|
(2) 配制一定物质的量浓度为0.2mol/LNaOH溶液500mL,填空并请回答下列问题:
|
应称量NaOH的质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的仪器 |
|
|
|
|
(3) 下列操作对配制的NaOH溶液浓度有偏高影响的是 。
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.将称量的Na OH固体露置在空气中的时间过长
OH固体露置在空气中的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.容量瓶用NaOH溶液润洗
21.(8分)某些化学反应可用下式表示(某些反应的条件已省略)
A + B → C + D + H2O
请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C、D均为气体且都 能使澄清石灰水变浑浊,则A与B的化学式是
。
能使澄清石灰水变浑浊,则A与B的化学式是
。
(3)若A为Na2O2,B为硫酸,则C和D的化学式是 。
(4)若A为红色单质,B为第二周期某种元素的最高价氧化物的水化物浓溶液,请写出符合上式的化学方程式:
 。
。
20.镁完全溶解于一定量浓硝酸反应,得到溶液A和NO2、N2O4、NO的混合气体,这 些气体与2.24LO2(标准状况)混合后通入水中正好完全被水吸收。若向所得溶液A中加入NaOH溶液至恰好完全沉淀,将所得沉淀过滤、洗涤、灼烧至质量不再变化,此时固体量为
些气体与2.24LO2(标准状况)混合后通入水中正好完全被水吸收。若向所得溶液A中加入NaOH溶液至恰好完全沉淀,将所得沉淀过滤、洗涤、灼烧至质量不再变化,此时固体量为
A.8g B.11.2 g C.16g D.29.6g
第Ⅱ卷 共计55分
19.某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实
 验方案:
验方案:
方案I:铜铝混合物 测定生成气体的体积

方案II:铜铝混合物 测定剩余固体的质量
下列有关判断中不正确的是
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案II更便于实施
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com