
7.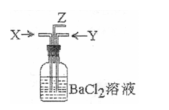 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
A.洗气瓶中产生的沉淀是亚硫酸钡
B.在Z导管出来的气体中无二氧化碳
C.在Z导管口有红棕色气体出现
D.洗气瓶中产生的沉淀是碳酸钡
6. (NH4)2SO4在一定条件下发生如下反应:
4(NH4)2SO4 ==== N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体通入BaCl2溶液,产生的沉淀为
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
5.已知0.2molCu2S与200mL 6.5mol/L的硝酸恰好完全反应,生成硝酸铜、硫酸、水和一种含氮物质,则该含氮物质的化学式为
A.N2O B.NO C.NH4NO3 D.NO2
4.在pH为4-5的环境中,Cu2+和Fe2+不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右。在漫漫加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去所得CuCl2溶液中的杂质离子,下列方法中可行的是
A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5
B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5
C.向溶液中通入Cl2,在通入NH3调节至pH4-5
D.向溶液中加入HNO3,再加入CuO粉末调节至pH4-5
3.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.第①到第④步的反应中,分解反应都是氧化还原反应
2.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是
A.分别在这两种物质的溶液中,加入少量澄清石灰水
B.分别加热这两种固体,并将生成的气体通入澄清石灰水中
C.分别在这两种物质的溶液中,加入少量氯化钙溶液
D.分别在这两种物质的等浓度的溶液中,加入等量的稀盐酸
1.下列关于钠的叙述错误的是
A.钠在常温下就容易被氧化 B.钠在空气中燃烧生成Na2O
C.钠燃烧时发出黄色的火焰 D.钠的密度比水小,熔点低于100℃
例1 在卢瑟福的a粒子散射实验中,有极少数a粒子发生大角度偏转,其原因是( )
A、原子的正电荷和绝大部分质量集中在一个很小的核上
B、正电荷在原子中是均匀分布的
C、原子中存在着带负电的电子
D、原子只能处于一系列不连续的能量状态中
分析:解答此例要求熟悉核式结构对a粒子散射现象的解释:
解答:由于电子与a粒子质量的悬殊,所以可判断:使a粒子偏转的不可能是带负电的电子;又由于只有极少数a粒子发生大角度偏转,所以又可判断:原子的正电荷和绝大部分质量集中在一个很小的范围内。故选A。
例2 对于基态氢原子,下列说法正确的是( )
A、它能吸收10.2eV的光子
B、它能吸收11eV的光子
C、它能吸收14eV的光子
D、它能吸收具有11eV动能的电子的部分动能
分析:注意到光子能量只能全部被吸收,而电子能量则可以部分被吸收。
解答:10.2eV刚好是n=1、n=2的能极差,而11eV不是,由玻尔政府知A正确。基太氢原子也能吸收14eV的光子而电离,电离后自由电子动能为0.4eV。它也可吸收动能为11eV的电子的部分能量(10.2eV),剩余0.8eV仍为原来电子所有。所以应选ACD。
例3 设氢原子的基态能量为E1。某激发态的能量为E,则当氢原子从这一激发态跃迁到基态时,所________________-(填“辐射”或“吸收”)的光子在真空中的波长为________。
分析:了解玻尔的原子理论,掌握光子能量与光波长间关系,即可解得此例。
解答:根据玻尔原子理论知:氢原子核外电子从高能态跃迁到低能态时,应辐射出光子,而能级差即为光子能量
E0=E-E1
另外,光子能量E0与光波长 间的关系为
间的关系为
 。
。
其中h为普朗克常量,c为真空中光速,由此可解得

此例答案:辐射,
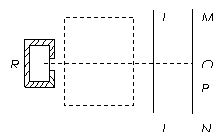
例4 如图25-1所示,R为放射源,虚线范围内有垂直于纸面的磁声B,LL’为厚纸板,MN为荧光屏,今在屏上P点处发现亮斑,则到达P点处的放射性物质微粒和虚线范围内B的方向分别为( )
 A、a粒子,B垂直于纸面向外
A、a粒子,B垂直于纸面向外
B、a粒子,B垂直于纸面向内
C、 粒子,B垂直于纸面向外
粒子,B垂直于纸面向外
D、 粒子,B垂直于纸面向内
粒子,B垂直于纸面向内
图25-1
分析:了解天然放射现象中三种射线的基本属性,是分析此例的基础。
解答:由于a粒子贯穿本领很弱,只能穿透几厘米空气,因此穿透厚纸板到达屏上P点处不可能是a粒子;由于 粒子不带电,穿过B区域不会发生偏转,因此到达P点处的也不可能是
粒子不带电,穿过B区域不会发生偏转,因此到达P点处的也不可能是 粒子;由此可知,到达P点处的必然是
粒子;由此可知,到达P点处的必然是 粒子。又由于
粒子。又由于 粒子带的是负电,因此用左手定则便可判断B的方向应该是垂直于纸面向内。所以应选D。
粒子带的是负电,因此用左手定则便可判断B的方向应该是垂直于纸面向内。所以应选D。
例5 两种放射性元素的原子 和
和 ,其半衰期分别为T和
,其半衰期分别为T和 。若经过2T后两种元素的核的质量相等,则开始时两种核的个数之比为________________;若经过2T后两种核的个数相等,则开始时两种核的质量之比为_________________。
。若经过2T后两种元素的核的质量相等,则开始时两种核的个数之比为________________;若经过2T后两种核的个数相等,则开始时两种核的质量之比为_________________。
分析:欲求解此例,必须正确理解半衰期的概念。
解答:此例考察的是半衰期的概念,可做如下分析:
若开始时两种核的个数分别为N1和N2,则经时间2T后剩下的核的个数就分别为
 和
和 ,而此时两种核的质量相等,于是有
,而此时两种核的质量相等,于是有

由此可得 N1:N2=b:4a。
若开始时两种核的质量分别为m1和m2,则经时间2T后剩下的核的质量就分别为 和
和 ,而此时两种核的个数相等,于是有
,而此时两种核的个数相等,于是有

由此可得  。
。
例6 静止的氮核 被速度是v0的中子
被速度是v0的中子 击中生成甲、乙两核。已知甲、乙两核的速度方向同碰撞前中子的速度方向一致,甲、乙两核动量之比为1:1,动能之比为1:4,它们沿垂直磁场方向进入匀强磁场做圆周运动,其半径之比为1:6。问:甲、乙各是什么核?速度各是多大?写出该反应方程。
击中生成甲、乙两核。已知甲、乙两核的速度方向同碰撞前中子的速度方向一致,甲、乙两核动量之比为1:1,动能之比为1:4,它们沿垂直磁场方向进入匀强磁场做圆周运动,其半径之比为1:6。问:甲、乙各是什么核?速度各是多大?写出该反应方程。
分析:注意到中子击中N核并生成两个新核的过程中系统的动量守恒,核进入磁场做圆周运动时的半径公式,再结合题设条件中两个新核的动量比,动能比可解得此例。
解答:设甲、乙两核质量分别为m甲,m乙,电量分别为q甲,q乙。
由动量与动能关系 和
和 可得
可得
 :
: =
= :
: =4:1。
=4:1。
又由 可得
可得
 :
: =
= :
: =6:1
=6:1
因为 +
+ =15m0,
=15m0, +
+ =7e,所以
=7e,所以
 =12m0,
=12m0, =3m0,
=3m0, =6e,
=6e, =e。
=e。
即甲为 ,乙为
,乙为 。
。
由动量守恒定律,可得
m0v0=
 +
+ =2
=2
 =24 m0
=24 m0
进而求得甲的速度 ,乙的速度
,乙的速度 。
。
核反应方程为  。
。
8、核能
对这部分内容,应该注意以下几点:
(1)已经确定核力的主要特性有:(1)是一种很强的力(相比于其他的力),(2)是一种短程力。
(2)一定的质量m总是跟一定的能量mc2对应。核子在结合成原子核时的总质量减少了,相应的总能量也要减少,根据能量守恒定律,减少的这部分能量不会凭空消失,它要在核子结合过程中释放出去。反过来,把原子核分裂成核子,总质量要增加,总能量也要增加,增加的这部分能量也不会凭空产生,要由外部来供给。能量总是守恒的,在原子核反应伴随有巨大的放能和吸能现象。
(3)核反应中释放或吸收的能量,可以根据反应物和生成物间的质量差用质能关系方程来计算。
(4)核反应中能量的吸、放,跟核力的作用有关。当核子结合成原子核时,核力要做功,所以放出能量。把原子核分裂成核子时,要克服核力做功,所以要由外界提供能量。
7、原子核的人工转变和原子核的组成
用高速运动的粒子去轰击原子核,是揭开原子核内部奥秘的要本方法。轰击结果产生了另一种新核,其核反应方程的一般形式为

其中 是靶核的符号,x为入射粒子的符号,
是靶核的符号,x为入射粒子的符号, 是新生核的符号,y是放射出的粒子的符号。
是新生核的符号,y是放射出的粒子的符号。
1919年卢瑟福首先做了用a粒子轰击氮原子核的实验。在了解卢瑟福的实验装置、进行情况和得到的实验结果后,应该记住反应方程式
 ,
,
这是人类第一次发现质子的核反应方程。另外,对1930年查德威克发现中子的实验装置、过程和结果也应有个基本的了解。值得指出的是,查德威克在对不可见粒子的判断中,运用了能量和动量守恒定律,科学地分析了实验结果,排除了 射线的可能性,确定了是一种粒子--中子,发现中子的核反应方程
射线的可能性,确定了是一种粒子--中子,发现中子的核反应方程
 ,
,
这同样是应该记住的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com