
(一)必考题(10题,共129分)
22. (1)(3分)在使用多用电表测电阻时,一同学选用“×10Ω”挡,调整欧姆零点后测量一电阻的阻值,发现表针向右偏转幅度太大,为了把电阻值测得更准确些,下列判断和做法正确的是:
(1)(3分)在使用多用电表测电阻时,一同学选用“×10Ω”挡,调整欧姆零点后测量一电阻的阻值,发现表针向右偏转幅度太大,为了把电阻值测得更准确些,下列判断和做法正确的是:
A.换用“×1Ω”挡,直接测量
B.换用“×100Ω”挡,直接测量
C.换用“×1Ω”挡,重新调整欧姆零点后测量
D.换用“×100Ω”挡,重新调整欧姆零点后测量
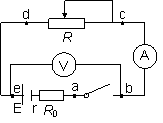
(2)(12分)某同学在用电流表和电压表测电池的电动势
和内阻的实验中,串联了一只2.5Ω的保护电阻R0,实验电路如图所示:
 ①连好电路后,当该同学闭合电键,发现电流
①连好电路后,当该同学闭合电键,发现电流
表示数为0,电压表示数不为0。检查各接线
柱均未接错,接触良好且未发生短路;在闭合
电键情况下,他用多用电表的电压档检查电路,
把两表笔分别接a与b,b与c,d与e时,示
数均为0,把两表笔接c与d时,示数与电压
表示数相同,若此电路只有一处断路,由此可
推断故障是 。
②按电路原理图及用多用电表的电压档检查电路,
把两表笔分别接c与d时的实物电路图以画线代替导线连接起来。
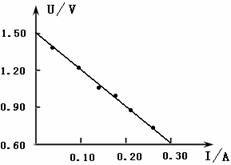
③ 排除故障后,该同学顺利完成实验,并测定数据,根据数据在坐标图中画出U-I图,则:电池的电动势为 ,内阻为
。(保留到小数点后两位)
排除故障后,该同学顺利完成实验,并测定数据,根据数据在坐标图中画出U-I图,则:电池的电动势为 ,内阻为
。(保留到小数点后两位)
23.(15分)如图所示,ABCD表示竖立在场强为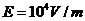 的水平匀强电场中的绝缘光滑轨道,其中轨道的BCD部分是半径为R的半圆环,轨道的水平部分与半圆环相切,A为水平轨道上的一点,而且,AB=R=0.2m,把一质量m=10g、带电量q=
的水平匀强电场中的绝缘光滑轨道,其中轨道的BCD部分是半径为R的半圆环,轨道的水平部分与半圆环相切,A为水平轨道上的一点,而且,AB=R=0.2m,把一质量m=10g、带电量q=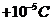 的小球在水平轨道的A点由静止释放后,小球在轨道的内侧运动(g=10
的小球在水平轨道的A点由静止释放后,小球在轨道的内侧运动(g=10 )。求:
)。求:
①小球到达C点时的速度的大小
 ②小球达到C点时对轨道的压力的大小
②小球达到C点时对轨道的压力的大小
24.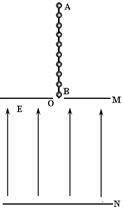 (17分)如图所示,M、N是水平放置的一对金属板,其中M板中央有一个小孔O,板间存在竖直向上的匀强电场.AB是一长9L的轻质绝缘细杆,在杆上等间距地固定着10个完全相同的带正电小球,每个小球的电荷量为q、质量为m,相邻小球距离为L.现将最下端小球置于O处,然后将AB由静止释放,AB在运动过程中始终保持竖直.经观察发现,在第4个小球进入电场到第5个小球进入电场这一过程中AB做匀速运动。求:①两板间电场强度E大小;
(17分)如图所示,M、N是水平放置的一对金属板,其中M板中央有一个小孔O,板间存在竖直向上的匀强电场.AB是一长9L的轻质绝缘细杆,在杆上等间距地固定着10个完全相同的带正电小球,每个小球的电荷量为q、质量为m,相邻小球距离为L.现将最下端小球置于O处,然后将AB由静止释放,AB在运动过程中始终保持竖直.经观察发现,在第4个小球进入电场到第5个小球进入电场这一过程中AB做匀速运动。求:①两板间电场强度E大小;
②上述匀速运动过程中速度v的大小.
25.(14分)25℃用0.1000mol/L的NaOH(aq)滴定20.00mL浓度为0.1000mol/L的HCl(aq),
(1)①下列滴定曲线的图像正确的是______(下图括号内是曲线上某一点的坐标)
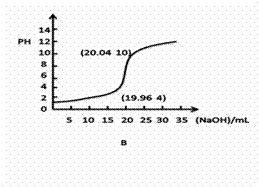
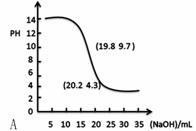
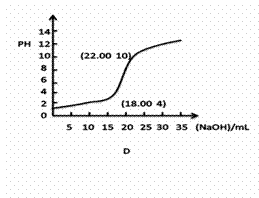
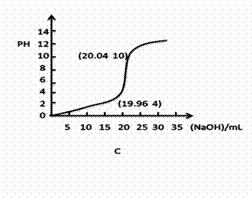
②若用0.1000mol/L的NaOH(aq)滴定20.00mL浓度为0.1000mol/L的一元弱酸
HB(aq),恰好中和pH 7(=、>、<)
③实验时 (能、否)用量筒量取HCl(aq)?指示剂变色 (是、否)立即读数?
(2)下表哪些指示剂可作为实验0.1000mol/L的NaOH(aq)滴定20.00mL浓度为0.1000mol/L的HCl(aq)的指示剂
|
指示剂 |
变色PH范围 |
颜色变化 |
|
百里酚蓝 |
1.3-2.8 |
红-黄 |
|
石蕊 |
5.0-8.0 |
红-蓝 |
|
甲基红 |
4.4-6.2 |
红-黄 |
|
酚酞 |
8.0-9.6 |
无色-紫红 |
|
甲基橙 |
3.1-4.4 |
红-黄 |
若用0.1000mol/L的NaOH(aq)滴定20.00mL浓度为0.1000mol/L的一元弱酸HB(aq)最好使用 作指示剂
(3)若用0.1000mol/L的NaOH(aq)滴定20.00mL某浓度HCl(aq),根据下列实验数据,计算c(HCl)=
|
实验序号 |
标准溶液NaOH(aq)体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
|
|
1 |
1.02 |
21.06 |
|
2 |
2.12 |
22.15 |
|
3 |
0.25 |
23.30 |
|
4 |
0.20 |
20.19 |
26.(15分)请回答下列有关化学平衡的问题:
(1)常温常压下,一定量的BCl3(g)和BF3(g)在一容器内反应形成BFCl2(g)和BClF2(g)
 2BCl3(g)+BF3(g) 3BFCl2(g)
①
2BCl3(g)+BF3(g) 3BFCl2(g)
①
 BCl3(g)+2BF3(g) 3BClF2(g) ②
BCl3(g)+2BF3(g) 3BClF2(g) ②
达平衡时,四种气态物质物质的量分别是0.9mol、4.5mol、0.45mol、2.0mol。
①上述两个反应中任意一个在常温常压下的化学平衡常数是 改变下列条件中的哪些可以提高BFCl2(g)的物质的量
a.增大容器体积 b.充入BCl3(g) c.充入BF3(g) d.充入BClF2(g)
②在恒容密闭容器中,若只发生上述反应中的①,达到平衡后,改变某一条件,下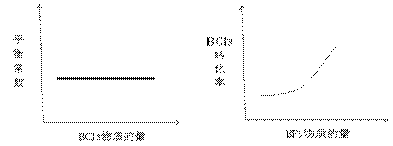 列示意图正确的是__________
列示意图正确的是__________
A B
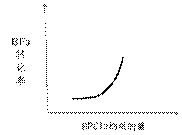
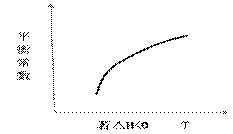
C D
 (2)已知可逆反应:M(g)+N(g) P(g)+Q(g),ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)= 1.4 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,N的转化率为 25% ,此时M的转化率为_________ ;
(2)已知可逆反应:M(g)+N(g) P(g)+Q(g),ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)= 1.4 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,N的转化率为 25% ,此时M的转化率为_________ ;
②若反应温度不变,反应物的起始浓度为:c(M)=c(N)=2 mol·L-1,达到平衡后,M的转化率为 ______ 。
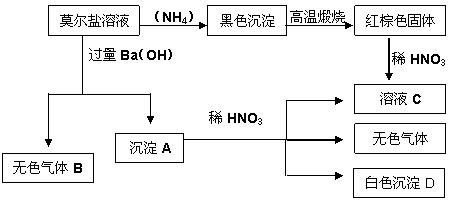
27.(14分)莫尔盐是硫酸盐的一种复盐,成分是(NH4)2Fe(SO4)2,它是一种重要的化学试剂,有如下反应:
根据以上关系,按要求填空:
(1)气体B的分子式为___________,其电子式为_______________。
(2)沉淀A与稀HNO3反应的离子方程式为___________________________。
(3)与2.7gAl完全反应的稀HNO3最多溶解Fe的质量为 ( )
A.2.8g B.5.6g C.2.7g D.8.4g
(4)NH4HSO4是硫酸的一种酸式盐,向0.01mol/L NH4HSO4 溶液中滴加NaOH溶液至中性,则C(Na+)_____ C(SO4 2-), C(NH4+)_____C(SO42-)(填>,<或=)
(5)请将下列溶液中NH4+浓度由大到小排序____________
①0.02mol/L NH4HSO4 溶液中
②0.01mol/L(NH4)2Fe(SO4)2溶液
③0.01mol/L(NH4)2 CO3溶液
28.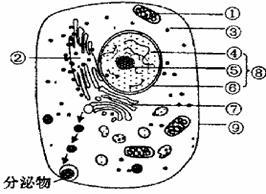 (11分)下图为某高等生物一个体细胞的结构模式图,据图回答下列问题:([ ]内填标号, 填汉字)
(11分)下图为某高等生物一个体细胞的结构模式图,据图回答下列问题:([ ]内填标号, 填汉字)
(1)若该细胞是人体的胰岛B细胞,其分泌物的形成过程中首先进入 加工,分泌物的排出依赖于细胞膜的______________性,需要消耗____________(结构)产生的能量。
(2)若该细胞能继续分裂,在分裂过程中周期性的消失和重建的结构有[ ]_______和[ ]__________。在细胞分裂时,_______中的遗传物质不一定能平均分配。
(3)某同学认为该细胞不是植物细胞,依据是该细胞_________________________。该同学想用新鲜的绿色植物叶片为材料,探究环境条件对细胞呼吸速率的影响,请帮助他提出一个探究课题: 。
29.(8分)图示绿色植物在水分及无机盐充足的条件下,光合作用强度与环境因素的关系,据图回答。
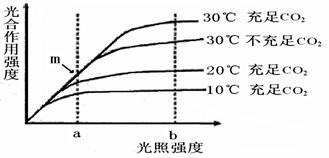
(1)从图中曲线可知影响光合作用强度的环境因素是 。
(2)m点限制光合作用强度的环境因素是 __ ,它影响了光合作用的 阶段。
(3)在光照强度为b、温度为200C时,限制光合作用的环境因素是 ,原因是 。如果大棚栽培蔬菜,在这种情况下应采取什么措施有利于蔬菜的生长: ___ _______ 。
30.(9分)回答下列小麦杂交育种的问题
假设小麦的高产与低产受一对等位基因控制(用A、a表示),基因型AA为高产,Aa为中产,aa为低产。抗锈病与不抗锈病受另一对等位基因控制(用B、b表示),只要有一个B基因就表现为抗病,这两对等位基因的遗传遵循自由组合定律。现有高产不抗锈病与低产抗锈病两个纯种品系杂交产生F1,F1自交得F2。
(1)F2中能稳定遗传的高产抗锈病个体的基因型为____ __,占F2中该性状个体的比例为______,在下图中画出F2各表现型及其数量比例的柱形图。
(2)选出F2中抗锈病品系自交得到的F3中基因型 BB: Bb:bb=_______________。
31.(11分) 甲图为某反射弧结构模式图,乙图是对甲图中部分结构的放大。
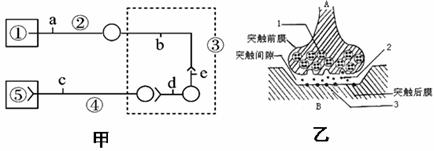
据图回答问题:
(1)甲图中______代表效应器,③代表 ,该图中有_____个乙图所示结构。
(2)乙图结构中,当突触小泡释放出的神经递质与[ ]_________结合,引发突触后膜发生的电位变化是___________________,从而完成兴奋从一个神经元传递到另一个神经元;兴奋在突触处的传递方向只能是A→B ,其原因是_________________。
(3)甲图中,提供电刺激设备、电位测量仪等必要的实验用具,验证兴奋在神经元之间进行单向传递的设计思路是:_____________________________________。
21.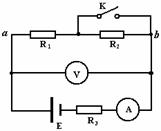 在如图所示的电路中,电源的电动势E恒定,内阻r = 1Ω,
在如图所示的电路中,电源的电动势E恒定,内阻r = 1Ω,
定值电阻R3=5Ω,电表均为理想的.当开关K 断开与闭
合时,ab 段电路消耗的电功率相同.则下列说法正确的
是 ( )
A.电阻R1 、R2可能分别为3Ω、6Ω
B.电阻R1 、R2可能分别为4Ω、5Ω
C.开关S 断开时电压表的示数可能小于S 闭合时的示数
D.开关S从断开到闭合,电压表的示数变化量大小与电流表的示数变化量大小之比一
定等于6
第Ⅱ卷
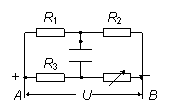
20.如图所示的电路中,R1=R2,滑动触头P正好位于滑动变
阻器的中点,当P向左滑动时 ( )
A.电源的路端电压增大 B.R3消耗的功率增大
C.R2消耗的功率减小 D.R1消耗的功率增大
19.已知如图,R1=30Ω,R2=15Ω,R3=20Ω,AB间为恒定电压
U=6V,A端为正极,电容C=2μF,为使电容器带电量达到
Q =2×10- 6C,可将电阻箱的阻值可以调节到 ( )
A.2Ω B.4Ω
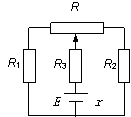 C.15Ω D.20Ω
C.15Ω D.20Ω
18.某同学将一直流电源的总功率PE、输出功率PR和电源内部的
发热功率Pr随电流I变化的图线画在了同一坐标上,如右图
中的a、b、c所示,根据图线可知 ( )
A.反映Pr变化的图线是c
B.电源电动势为8v
C.电源内阻为2Ω
 D.当电流为0.5A时,外电路的电阻为6Ω
D.当电流为0.5A时,外电路的电阻为6Ω
17.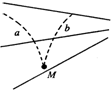 如图所示,实线为不知方向的三条电场线,从电场中M点以相同速度飞出a、b两个带电粒子,仅在电场力作用下的运动轨迹如图中虚线所示。则 ( )
如图所示,实线为不知方向的三条电场线,从电场中M点以相同速度飞出a、b两个带电粒子,仅在电场力作用下的运动轨迹如图中虚线所示。则 ( )
A.a一定带正电,b一定带负电
B.a的速度将减小,b的速度将增加
C.a的加速度将减小,b的加速度将增加
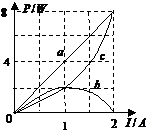 D.两个粒子的电势能一个增加一个减小
D.两个粒子的电势能一个增加一个减小
16.质量为m的带正电小球A悬挂在绝缘细线上,且处在场强为E的匀强电场中,当小球A静止时,细线与竖直方向成30°角,已知此电场方向恰使小球受到的电场力最小,则小球所带的电量应为 ( )
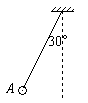 A.
A.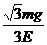 B.
B. 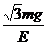
C.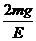 D.
D.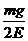
15.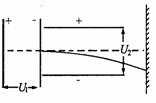 如图所示,一价氢离子和二价氦离子的混合体,经同一加速
如图所示,一价氢离子和二价氦离子的混合体,经同一加速
电场U1同时加速后,垂直射入同一偏转U2电场中,偏转后,
打在同一荧光屏上,则它们 ( )
A.同时到达屏上同一点
B.先后到达屏上同一点
C.同时到达屏上不同点
D.先后到达屏上不同点
14.下列关于静电场的说法正确的是 ( )
A.在孤立的点电荷形成的电场中没有场强完全相同的两点,但有电势相等的两点
B.正电荷只在电场力作用下,一定从高电势向低电势运动
C.场强为零处,电势不一定为零;电势为零处,场强不一定为零
D.初速度为零的正电荷只在电场力作用下一定沿电场线运动
13.已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25kJ/mol
2 Fe3O4(s)+CO2(g) = 3 Fe2O3(s)+CO(g) △H=+47kJ/mol
Fe3O4(s) +CO(g) =3FeO(s)+ CO2(g) △H=+19kJ/mol
则反应FeO(s)+ CO(g)= Fe(s)+ CO2(g) 的△H= ( )
A.-22 kJ/mol B.+11 kJ/mol C.-11 kJ/mol D.+22 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com