
20、25℃时,在含有大量Ba2+的某澄清透明溶液中,由水电离产生的OH-物质的量浓度为1×10-12mol/L,则在此溶液中还可能大量共存的离子组有
A.Na+、Fe2+、NO3- B.K+、CH3COO-、SO42-
C.NH4+、HCO3-、SCN- D.Cu2+、Mg2+、Cl-
19、在一定温度下,已知有关某溶液的一些数据:①溶液的质量,②溶剂的质量,③溶液的体积,④溶质的摩尔质量,⑤溶质(气体)的体积(Vm已知),⑥溶液的密度,⑦溶液的质量分数.利用下列各组数据计算该溶液的物质的量浓度,不能算出的一组是
A.③⑤ B.②④⑤⑥ C.①④⑥ D.①②③④
18、能实现下列物质间直接转化的元素是
A. 硅 B. 硫 C. 铜 D. 铁
17、对于化学反应方向的确定,下列说法正确的是
A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向
B.温度、压强一定时,放热的熵增加的反应一定不能自发进行
C.反应焓变是决定反应能否自发进行的唯一因素
D.固体的溶解过程仅与焓变有关
16、常温下,有关下列溶液的叙述正确的是
A.100 mL pH=12的NaOH溶液中加入pH=2的HA至pH刚好等于7,所得溶液的总体积V ≥ 200 mL
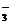 B.等浓度、等体积的Na2CO3溶液与盐酸混合后,存在如下关系:
c(Na+)>c(HCO )=
c(Cl-)>c(OH-)>c(H+)
B.等浓度、等体积的Na2CO3溶液与盐酸混合后,存在如下关系:
c(Na+)>c(HCO )=
c(Cl-)>c(OH-)>c(H+)
C.AgCl沉淀可以转化为AgI沉淀,则说明溶解度AgI>AgCl
D.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种物质的溶液中,c(NH4+)大小关系为①=②>③
15、25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是
A.均存在电离平衡和水解平衡 B.存在的粒子种类相同
C.c(OH-)前者大于后者 D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
14、X、Y、Z、W为原子序数由小到大排列的短周期元素,X、Y同主族,Z、W同周期。下列说法正确的是(m、n均为正整数)
A.若Z(OH)n为强碱,则W(OH)m也一定为强碱
B.若HnXOm为强酸,则W的气态氢化物溶于水一定显酸性
C.若Z、W为金属元素,Z的单质一定能从W的盐溶液中置换出W的单质
D.若Z的最高正价为+4,Z的最高价氧化物一定不与水反应
13、下列离子方程式正确的是
A.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.用氨水吸收少量二氧化硫:SO2+2NH3·H2O=2NH4++SO32-+H2O
C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+
D.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-==CO2↑+H2O
12、下列结论错误的是
①微粒半径:K+>Al3+>S2->C1- ②氢化物的稳定性:HF>HC1>H2S>PH3>SiH4
③离子的还原性:S2->C1->Br->I- ④氧化性:C12>S>P
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.只有① B.①③ C.②④⑤⑥⑦ D.①③⑤
11、关于反应:①2C2H2(g) + 5O2(g) = 4CO2 (g) + 2H2O(l) ΔH= -2600kJ/mol ;
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol ;
③CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH=+216 kJ/mol
下列叙述正确的是
A.CO的燃烧热为-283 kJ/mol
B.在③反应时,若加入催化剂,可以使ΔH减小
C.若有3.2g CH4与足量水蒸汽按③反应,则放出热量是43.2 kJ
D.若生成相同质量的CO2,则放出的热量C2H2大于CO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com