
2、暴雨洪涝
形成:源源不断的水汽供应;强烈的上升运动;形成降水的天气系统持续时间长
分布:亚洲最多。我国主要发生在南方和东部地区
 利用气象卫星对暴雨、洪水进行监测,提高预报正确率,减轻洪涝灾害损失。
利用气象卫星对暴雨、洪水进行监测,提高预报正确率,减轻洪涝灾害损失。
|
非工程措施:洪泛区的土地管理;建立洪水预警系统;拟定居民的应急撤离计划和对策;实行防洪保险等。
1、台风
概念:西北太平洋上热带气旋中心附近最大风力在12级或以上(印度洋和大西洋上称为飓风)。
形成:热带或副热带海面温度在26℃的广阔洋面上,西北太平洋发生频率最高、强度最大。
危害:主要由强风、特大暴雨和风暴潮造成,我国登陆地区主要集中在广东、台湾、海南、 福建等省。
措施:加强台风的监测和预报。对台风的探测主要是利用气象卫星。
2、开发利用
农业:是农业自然资源的重要组成部分。决定该地的种植制度(作物结构、熟制、配置和种植方式)
合理充分利用气候资源的措施:间作、套种方式,塑料大棚、温室、生态农业、立体农业。
|
风与城市规划:大气污染工厂建在下风向、垂直风向的郊外或最小风频风向上风向。
 公路、铁路考虑暴雨、泥石流、大风出现的强度和频率以及冻土、积雪的深度等
公路、铁路考虑暴雨、泥石流、大风出现的强度和频率以及冻土、积雪的深度等
交通 桥涵孔径大小、路基高低等根据暴雨强度设计。
机场选择低云、雾和暴雨出现频率较少、风速较小,应选在距城市较远、地势较高的地方。
旅游:吉林市的雾淞、哈尔滨的冰雕。
1、特点
目前人类利用的气候资源:太阳辐射、热量、降水和风等。
|
 为人类生产和生活提供原料、能源和必不可少的物质条件。
为人类生产和生活提供原料、能源和必不可少的物质条件。
离不开对其开发利用的技术条件和资金投入。
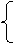 普遍存在性,只是数量多少和结构的差异。
普遍存在性,只是数量多少和结构的差异。
|
有较大的变率。
20.(10分)某化学兴趣小组探讨Fe3+与SO32-之间的反应情况,请您参与并协助完成实验。
(1)提出猜想:①发生氧化还原反应。请你配平反应的离子方程式
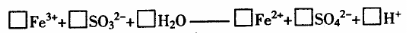
②发生双水解反应。其反应的离子方程式
2Fe3++3SO32-+6H2O Fe(OH)3(胶体)+3H2SO3
Fe(OH)3(胶体)+3H2SO3
(2)实验验证:
①检验Na2SO3溶液是否变质。取Na2SO3溶液,加入过量盐酸后,再加入BaCl2溶液,无沉淀产生。结论:_________________________________写出有关反应的离子方程式:
②取5mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到:溶液由黄色变为红棕色。无气体产生,也没有沉淀产生。
③将②溶液加入过量稀盐酸,分成两等份,一份加入BaCl2溶液,产生白色沉淀;另一份加入几滴KSCN溶液,溶液呈血红色。
(3)得出结论:根据上述实验现象,得出Fe3+与SO32-之间发生反应的情况是:
(4)拓展探究:实验小组的一位同学在FeCl3溶液中加入Na2CO3溶液,观察到有红褐色沉淀产生,并有无色气体放出。
①写出反应的离子方程式:
②SO32-的水解能力___________CO32-(填“大于”,“小于”)
19.(12分)H2O2是重要的氧化剂,还原剂,它的水溶液常用来消毒、杀菌、漂白等。
请回答下列有关问题。
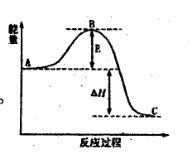 (1)2H2O2(l)=2H2O(l)+O2(g)反应过程中
(1)2H2O2(l)=2H2O(l)+O2(g)反应过程中
的能量变化如图所示。已知1 mol H2O2分解
为1 mol H2O的△H=-98.23 kJ·mol-1
①H2O2的分解反应常温下能自发进行,其原
因是 。
该反应常用MnO2作催化剂,则加入MnO2
会使图中B点 (填“升高”、
“降低”),图中△H= 。
(2)H2O2和H2O都是极弱电解质;水电离生成H3O+和OH-即:H2O+H2O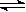 H3O++OH-叫做水自偶电离;H2O2也有极微弱的自偶电离,其自偶电离的方程式为
H3O++OH-叫做水自偶电离;H2O2也有极微弱的自偶电离,其自偶电离的方程式为
(3)某化学兴趣小组用酸化KMnO4标准溶液滴定H2O2溶液样品,测定H2O2溶液中H2O2的含量。其反应的离子方程式为:
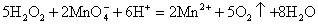
①酸化KMnO4溶液不能放在碱式滴定管中,原因是
②用KMnO4溶液滴定H2O2样品,终点时溶液颜色变化为
③滴定时,若滴定管中滴定液下降到活塞处才达到滴定终点,则能否由此得出准确的测定结果,原因是什么?
18. (13分)金属的单质及其化合物与工农业生成、日常生活有密切的联系。请回答下列问题:
(13分)金属的单质及其化合物与工农业生成、日常生活有密切的联系。请回答下列问题:
(1)一定温度下,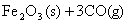
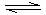
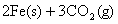
①请用上述反应中某种气体的有关物质理量来说明反应已达平衡状态(若有多种,只回答两种即可)
i
ii
②若平衡时,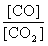 比值随温度的升高而增大,则该反应的正反应是
反应(填“吸热”或“放热”)
比值随温度的升高而增大,则该反应的正反应是
反应(填“吸热”或“放热”)
(2)钢铁发生电化腐蚀时,负极电极反应式为
(3)水体中铅污染问题备受关注,铅在水溶液中的各种存在形态浓度分数随溶液pH变化关系如图所示。
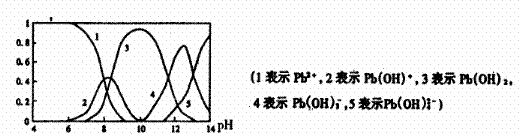
①往Pb(NO3)2溶液中滴入 溶液后,
溶液后,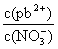 减小,可能的原因是
减小,可能的原因是
②向铅污染的水中加入脱铅剂(用EH表示),脱铅过程中主要发生如下反应:
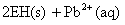
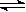
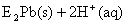
则:该反应的平衡常数数表达式为K= ;脱铅反应最合适的pH范围为6-7,请解释原因:
③向含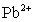 的污水中加入FeS固体,也可除去
的污水中加入FeS固体,也可除去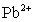 的污染,当
的污染,当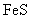 合
合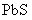 同时存在时,溶液中
同时存在时,溶液中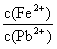 =
[已知:
=
[已知: =6.8×10-18mol2·L-2;
=6.8×10-18mol2·L-2;
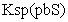 =3.4×10-28 mol2·L-2]
=3.4×10-28 mol2·L-2]
17.(14分)海洋是资源的宝库,蕴藏丰富的化学元素。氯元素就是其中之一。
(1)在光照情况下,H2和Cl2发生如下反应:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
则:氯元素在元素周期表中的位置是 ;
在短周期主族元素中与氯元素相邻元素原有半径从大到小顺序是
反应②中形成的化学键属于 (填“离子键”或“共价键”)
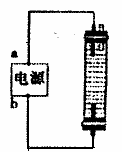 (2)某同学用石墨作电极,设计一种如右图所示的家用环保型消
(2)某同学用石墨作电极,设计一种如右图所示的家用环保型消
毒液发生器,为使Cl2完全吸收,则a为 极(填
“正”、“负”);与b极相连石墨电极上发生反应的电极反应
式 。
(3)常温下,将NaCl固体放入烧杯中,加入适量水充分溶解后,
烧杯中仍有少量NaCl固体;再向烧杯的溶液中通入HCl气
体,法线烧杯中固体增多。请分析原因:
(4)NH4Cl是一种重要的化肥。
①用0.1 mol·L-1的盐酸滴定0.1 mol·L-1的氨水,滴定过程中不可能出现的结果是:
a.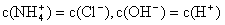
b.
c.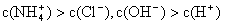
d.
② 溶液中存在:
溶液中存在: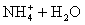
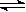
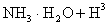 ,则该反应常温下的平衡常数K=
(已知:常温下,
,则该反应常温下的平衡常数K=
(已知:常温下,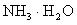 的电离平衡常数Kb=1.7×10-5 mol·L-1)
的电离平衡常数Kb=1.7×10-5 mol·L-1)
16.(6分)请回答下面两个问题
(1)对于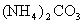 溶液,某同学写出了如下的正确关系式:
溶液,某同学写出了如下的正确关系式:
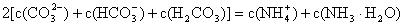
请分析该同学的依据是
(2)某反应:A(g)+B(g)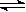 C(g)在任一时刻的正、逆反应速率可用
C(g)在任一时刻的正、逆反应速率可用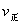 、
、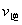 表示:
表示: ,
,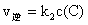 ,其中
,其中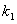 、
、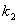 在一定温度下均为常数。c(A)、c(B)、c(C)分别表示某时刻三种物质的物质的量浓度(mol·L-1)。
在一定温度下均为常数。c(A)、c(B)、c(C)分别表示某时刻三种物质的物质的量浓度(mol·L-1)。
①上述反应达到平衡时,物质C与A、B的浓度关系可表示为 。
②在300 K时,开始反应时的A、B浓度均为0.1 mol·L-1,达到平衡时B的转化率为50%,则该温度下反应的平衡常数= 。
15.某化学科研小组研究在其他条件不变时,改变其一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):
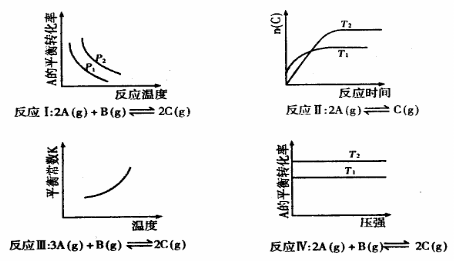
根据以上规律判断,下列结论正确的是 ( )
A.反应Ⅰ:△H>0, B.反应Ⅱ:△H>0,
B.反应Ⅱ:△H>0,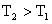
C.反应Ⅲ:△H<0 D.反应Ⅳ:△H<0,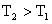
第Ⅱ卷(非选择题,共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com