
19.答案:C
[解析]本题以氯元素为载体,从氧化还原、原子结构、收集方法不同角度进行考查,体现了山东理综化学选择题的命题模式。氯气与水的反应既是氧化剂也是还原剂;同一元素的不同核素化学性质几乎完全相同而物理性质不同;D中提Cl2的体积未指明是标准状况。实验室制备Cl2,可用排饱和食盐水集气法收集也可用瓶口向上排空气法收集,故C正确。
18.答案:A
[解析]根据2NxOy+2yCu=2yCuO+xN2,以及题中数据反应后气体体积为反应前气体体积的一半,可以得到x=1,因此只有A选项符合题意。
[点评]本题主要考查气体摩尔体积,阿伏伽德罗常数等知识,题目较为老套,而且这种题目在若干年前就已经经常出现了。
17. 答案:C
答案:C
 [解析]A项,pH=13也就是意味着c(H+)=1×10-13mol·L-1,则c(OH-)=1×10-1mol·L-1,所以n(OH-)=n(OH-)×V=1×10-1mol·L-1×1L=0.1
[解析]A项,pH=13也就是意味着c(H+)=1×10-13mol·L-1,则c(OH-)=1×10-1mol·L-1,所以n(OH-)=n(OH-)×V=1×10-1mol·L-1×1L=0.1
mol,所以N(OH-)=0.1NA;B项,发生的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O(该反应为歧化反应),n(Cl2)=0.1mol,那么转移电子的数目应该为0.1NA;C项,乙烯和丁烯的最简式都是CH2,则n(CH2)=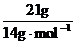 =1.5mol,所以n(C)=01.5mol,N(C)=1.5NA;D项,标准状况下,甲醇为液态,那么甲醇的物质的量就不是1mol,则所含有的氧原子个数也不为NA。
=1.5mol,所以n(C)=01.5mol,N(C)=1.5NA;D项,标准状况下,甲醇为液态,那么甲醇的物质的量就不是1mol,则所含有的氧原子个数也不为NA。
 [考点分析]以阿伏伽德罗常数为载体考察如下知识点①考查22.4L/mol的正确使用;②考查在氧化还原反应中得失电子数的计算;③正确表示一定物质的量的某物质微粒所含某种微粒的个数;④考查在标准状况下一定体积的气体分子所含的分子数和原子数。
[考点分析]以阿伏伽德罗常数为载体考察如下知识点①考查22.4L/mol的正确使用;②考查在氧化还原反应中得失电子数的计算;③正确表示一定物质的量的某物质微粒所含某种微粒的个数;④考查在标准状况下一定体积的气体分子所含的分子数和原子数。
16.答案:D
[解析]A选项没有指出条件是否为标准状况;B选项中Na+ 的物质的量为0.2mol,因此Na+
的物质的量为0.2mol,因此Na+ 应为0.2NA个;C选项中H2和Cl2反应的化学方程式为H2+Cl2=2HCl,因此1 mol H2与1 mol C12反应生成2NA个HCl分子;D选项中Ca失电子的反应为Ca-2e-=Ca2+,因此1 mol Ca失去2NA个电子数变成Ca2+。所以D选项正确。
应为0.2NA个;C选项中H2和Cl2反应的化学方程式为H2+Cl2=2HCl,因此1 mol H2与1 mol C12反应生成2NA个HCl分子;D选项中Ca失电子的反应为Ca-2e-=Ca2+,因此1 mol Ca失去2NA个电子数变成Ca2+。所以D选项正确。
15.答案:C
[解析] K2SO4中阴离子为硫酸根,1mol硫酸根所带电荷为2mol,A错误。乙烯和C3H6的最简式相同均为CH2,28g混合气有2molCH2,所以含4molH原子,B错误。Fe3+在溶液中发生水解,0.1molFeCl3溶液中,Fe3+的物质的量要小于0.1mol,D错误。
14.答案:C
[解析]A项,镁的最外层电子数为2,故错;B项,乙酸为弱电解质,部分电离,故H+小于0.1NA,错;C项,CH4的质子数为10,正确;D项,乙醇标状下不是气体,错。
13.[解析]选项A中根据稀释前后溶质的质量不变得:10mL×ρ(前)×98%=100mL×ρ(后)×ω(后),所以ω(后)=,由于反应前后溶液的密度不能确定,所以其质量分数也不能确定;选项B中n(O2)=1mol,O元素的化合价从-1价变为0价,所以每个O原子失去1个电子,故反应中转移的电子数为2NA;选项C中分子数为NA的CO和C2H4其物质的量为1mol,则在标准状况下所占的体积为22.4L,由于它们的摩尔质量都是28g·mol-1,即平均摩尔质量也为28g·mol-1,所以其质量为28g;选项D中由于NH4++H2O NH3·H2O+OH-,浓度越小,水解程度越大,所以溶液中所含NH4+的物质的量不同。
NH3·H2O+OH-,浓度越小,水解程度越大,所以溶液中所含NH4+的物质的量不同。
12.答案:C
[解析]选项A中n(Al)=1mol,Cl2的物质的量不能确定,当Cl2的物质的量小于1.5mol时,转移的电子数小于3NA,当Cl2的物质的量等于或大于1.5mol时,转移的电子数为1.5mol;己烷在标准状况下为液体,所以其物质的量不能用n=来确定;选项C中含有NA个分子的CO2和O2,其物质的量为1mol,而不管是CO2还是O2 1mol中均含有2mol的O,NA个CO2和O2的混合气体所含的O数为1mol;选项D中CO32-为弱酸根离子,水解后使得CO32-的物质的量小于1mol,CO32-的个数小于NA。
11.答案:C
[解析]选项A中CCl4在标准状况下为液体,所以其物质的量时不能用n=V/22.4计算,选项B中n(N2)=0.5mol,1molN2中含有14mol电子,所以0.5molN2含有7NA;选项C中在标准状况下,22.4L的气体为1mol,不管是混合气体还是纯净的气体,所含的分子数均为NA;选项D中生成1molH2,转移的电子数必定为2NA。
10.答案:B
[解析]根据阿伏加德罗定律可知同温同压下气体的密度之比等于摩尔质量之比,即=,由于>1,所以M(甲)>M(乙);由于它们的质量相等,所以甲的物质的量比乙的物质的量少,甲的分子数比乙少;由于它们的外界条件相同,所以它们的摩尔体积相同。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com