
27. (4分)
(4分)
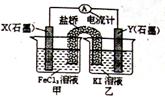
控制适宜条件,将反应 设计成如图所示的原电池。
设计成如图所示的原电池。
(1)反应开始时,Y(石墨)是 。(填“正极”或 “负极”),该电极反应式为--。
(2)当电流计读数为零后,在装置甲中溶入FeCl2固体,
X(石墨)上发生 反应。(填“氧化”或“还原”)
16.(8分)
氮化硅(Si3N4)是一种新型陶瓷材料,800℃下,石英、焦炭和氮气通过以下反应可制得氮化硅。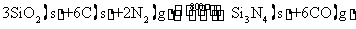
(1)该反应中的氧化产物是 。
(2)800℃下,该反应的平衡常数表达式K= .
(3)已知:该反应K800℃ >K 850℃ ,则该反应是 反应。(填“放热”或“吸热”)
(4)一定温度下,在2L密闭容器内,充入一定量SiO2、C、N2进行上述反应,N2的物质的
量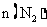 随时间(t)的变化如下表:
随时间(t)的变化如下表:
|
t/min |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(N2)/mol |
2.00 |
1.40 |
1.12 |
1.00 |
1.00 |
1.00 |
从反应初到平衡时,CO的平均生成速率为v(CO)= mol·L-1·min-1.
(5)若压缩(4)中的密闭体系,则上述平衡向 反应方向移动。(填“正”或“逆”)
(6)能使SiO2的转化率增大的措施是 。(填标号)
A.及时分离出CO气体 B.降低温度
C.增加C的初始量 D.使用适宜催化莉
25.(8分)
下表为元素周期表的一部分,请根据元素①一⑧在表中的位置,用化学用语回答下列问题:
 族 族周期 |
IA |
|
0 |
|||||
|
1 |
① |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)①、⑤、⑥的原子半径由大到小的顺序为 。
(2)铜单质与③的最高价氧化物的水化物的稀溶液反应的化学方程式为 。
(3)⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是 。
(4)甲、乙、丙3种物质均含有上表中同一元素,常温下,乙为固体单质,甲和丙均为气态化合物,且可发生反应: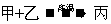 。
。
①写出上述反应的化学方程式: 。
②往200mL2mol·L-1NaOH溶液通入6.72L(标准状况)气体甲,完全反应后溶液中含有的阴离子为 。
24.某学习小组进行如图所示实验,下列有关叙述错误的是
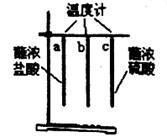 A.温度计指示的温度高低是Tc>Tb>Ta
A.温度计指示的温度高低是Tc>Tb>Ta
B.实验说明:浓硫酸吸水时放热
C.实验说明:浓盐酸挥发时放热
D.实验应用了对比法
23.广义的水解观认为,无论是盐的水解还是非盐的水解,都是每种反应物解离成两部分,然后两两重新结合生成新的物质。根据上述观点,下列说法错误的是
A.CaO2的水解产物是Ca(OH)2和H2O2
B.NaClO的水解产物之一是HClO
C.PCl3的水解产物是PH3和HClO
D.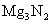 与盐酸反应的产物是NH4Cl和MgCl2
与盐酸反应的产物是NH4Cl和MgCl2
22.下列图示能达到实验目的的是
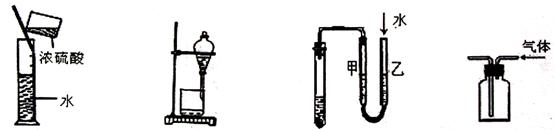
A.稀释浓硫酸 B.分离水与酒精 C.检查装置气密性 D.收集CO2气体
21.不能实现下列物质间直接转化的元素是

A、碳 B、氮 C、硫 D、铝
20.MCFC型燃料电池可同时供应电和水蒸气,电解质为熔
融K2CO3。该电池的总反应为: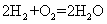 ,负极反应为
,负极反应为
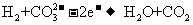 。下列推断正确的是
。下列推断正确的是
A.负极发生还原反应
B.正极反应为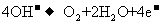
C.电池工作时,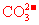 移向负极
移向负极
D.电池供应1mol水蒸气,转移4mol电子
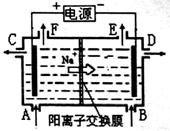
19.右图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图。据图判断下列说法不正确的是
A.从E口逸出的气体是H2
B.从F口逸出的气体是Cl2
C.标准状况下,生成22.4LCl2的同时有2molNaOH生成
D.从C口流出的是NaOH溶液
18.已知室温下,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.溶液的pH=4
B.HA的电离平衡常数约为l×10-7
C.HA电离出的c(H+)与水电离出的c(H+)之比为108
 D.升高温度,溶液的pH减小
D.升高温度,溶液的pH减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com