
3、下列说法正确的是( )
A、人站在地上之所以能平衡,是因为人对地的压力等于地面对人的支持力
B、大人与小孩拔河,因大人拉小孩的力必大于小孩拉大人的力,所以大人必胜
C、先有作用力,然后才有反作用力,所以开始一段时间只有作用力,没有反作用力
D、作用力与反作用力大小相等,方向相反的关系与物体的运动状态无关
2、关于弹力的下列说法中,正确的是( )
A、相互接触的物体间一定有弹力
B、只有发生弹性形变的物体,才会对跟它接触的物体产生弹力
C、只有受弹簧作用的物体,才会受到弹力作用
D、弹簧受到的弹力是由于它本身发生的弹性形变而产生的
1、由牛顿第二定律可以推出m=F/a,此公式的物理意义为( )
A、m与F成正比
B、m与a成反比
C、m由F与a两个因素共同决定
D、m由物体自身决定,但可以用F与a的比值来量度
硝酸与铁反应,随用量的不同,产物可能是 Fe(NO3)2 或 Fe(NO3)3 这时可用极限法解。
如果产生的气体产物不单一,可能也要用极限法解。
例14.把22.4 g铁完全溶解于某浓度的硝酸中,反应只收集到 0.3 mol NO2 和0.2 mol NO。
下列说法正确的是( )。
A.反应后生成的盐只有Fe(NO3)3 B.反应后生成的盐只有Fe(NO3)2
C.产物中Fe(NO3)2和Fe(NO3)3的物质的量之比为1:3 D.产物中Fe(NO3)2和Fe(NO3)3的物质的量之比为3:1
解析:用极限法判断:22.4 g铁如完全转化为Fe(NO3)3转移1.2 mol电子; 如完全转化为Fe(NO3)2转移 0.8 mol 电子,反应中实际转移0.3×1+0.2×3=0.9 mol 电子,所以产物中既有Fe(NO3)2又有Fe(NO3)3这,分别设Fe(NO3)2和Fe(NO3)3的物质的量分别x、y,
则(据得失电子守恒有) :
x+y=0.4① 2×x+3×y=0.9② 解之:x=0.3 y=0.1, 答案 选D。
例 15. 0.03 mol 的铜完全溶于硝酸,产生氮的氧化物NO、NO2 、N2O4
混合气体共 0.05 mol,该混合气体的平均相对分子量可能是( )。
A . 30 B . 46 C. 50 D. 66
解析:假设0.05 mol 气体全是NO则转移 0.15 mol 电子;假设0.05 mol 气体全是NO2则转0.05 mol电子;假设0.05 mol气体全是N2O4则转移 0.1 mol电子,而实际 0.03 mol 的铜在反应中转移 0.06 mol的电子,因为 0.06 介于 0.05 和 0.15 之间;0.05和0.1 之间;所以用极限法判断组成可能有两种极限。
(1) 气体为NO2和NO的混合气体.
解:设NO2和NO的物质的量分别为x、y则(据得失电子守恒) :
x+y=0.05① x+3y=0.06② 解之:x=0.045 y=0.005
所以平均相对分子量为:(46×9+30×1)/10=44.4
(2)气体为NO2和N2O4的混合气体:
解:设NO2和N2O4的物质的量分别为x、y则(据得失电子守恒) :
x+y=0.05① x+2y=0.06② 解之:x=0.04 y=0.01
所以平均相对分子量为:(46×4+92×1)/5=55.2
实际分子量应介于44.4与55.2之间,答案 选 B C。
32.64/64)×2=((30%×m)/34)×2解得:m=57.8 g
终态法的运用使许多复杂问题简单化,在化学计算中具有非常重要的地位。
例11.铜镁合金4.6 g 完全溶于浓硝酸中,若反应中硝酸被还原,只产生 4480 mL NO2 气体和 336 mL N2O4气体(标准状况下).反应后的溶液中加足量NaOH溶液,生成沉淀的质量为 g。
解析: 反应中铜镁合金失去电子,最终转化为 Cu(OH)2 和 Mg(OH)2 沉淀,比较始态和终态,固体增加的质量为OH-的质量,而OH-的物质的量等于转移的电子的物质的量,再根据气体计算转移的电子的物质的量:
n=4480 mL /22400 mL·mol-1+(336 mL/22400 mL·mol-)×2=0.23 mol。
所以沉淀的质量为: 4.6+0.23×17=8.51 g
例12.1.92 g Cu投入到一定量的浓硝酸中,铜完全溶解,生成的气体的颜色越来越浅,共收集到 672 mL 的气体(标准状况下).将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为 mL。
A . 168 B. 224 C . 336 D. 504
解析: 从反应的始态和最终状态看,铜在反应中失去电子,氧气在反应中得电子,设通入的氧气的体积为x mL,则:
1.92/64)×2=(x/22400) ×4 解得:x=336, 答案选C。
例13.将32.64 g 铜粉与140 mL 一定量浓硝酸恰好完全反应,铜完全溶解,反应后收集到的气体在标准状况下的体积为11.2 L.(假设反应中只产生 NO 或NO2 )请回答:
(1)NO的体积为 mL;NO2的体积为 mL。
(2)待产生的气体全部释放后,向溶液中加入v mL a mol/L的 NaOH 溶液,恰好使溶液中的 Cu2+ 全部沉淀,则原硝酸的浓度为 a mol/L
(3)欲使铜与硝酸反应生成的气体在溶液中完全转化为 NaNO3 ,至少需要30%的双氧水 g。
解析:(1)设反应中产生NO和NO2的体积分别为x、y(据得失电子守恒有)
x+y=11.2① (x/22.4)×3+(y/22.4) ×1=(32.64/64)×2 解得x=5.824 L y=5.376 L
(2)根据反应后的溶液中只有一种溶质NaNO3 ,设原硝酸的物质的量浓度为C
(由氮元素守恒)则 0.14×C= 10-3 ×v×a + 11.2/22.4
得原硝酸的浓度为: C= (10-3 va +0.5)/0.14
(3) 从反应的始态和最终状态看,铜在反应中失去电子,双氧水在反应中得到电子,需要30%的双氧水的质量为m 则(据得失电子守恒有):
一般情况下:金属失去的电子被+5价的氮得到,转化为 NO 或 NO2 ,根据得失电子解题。
例 9.在Cu与稀硝酸反应中,如果有1 mol 硝酸被还原,则被氧化的铜的物质的量为 mol。
A . 3/8 B. 8/3 C . 3/2 D. 2/3
解析: 设被氧化的铜的物质的量为x mol.则根据得失电子守恒有:1×(5-2)=2x
答案 选C
例10.题见例7 (3) 求生成的气体的成分。
解析: (2)已解出铜银的物质的量分别为0.3 、 0.1,则 NO 和 NO2的物质的量的关系式为:
0.3×2+0.1×1=3n(NO)+ n(NO2) ①(得失电子守恒)
n(NO)+ n(NO2)=6.72/22.4 ②
解得n(NO)=0.2 n(NO2)=0.1
参加反应的硝酸一部分显酸性,生成硝酸盐,另一部分作氧化剂,一般转化为氮的氧化物(NO或NO 2),根据氮元素守恒解题。
例5.将25.6 mg Cu 与1.4×10-3 mol 的浓硝酸恰好完全反应,反应后收集到的气体在标准状况下的体积为 ml。(假设反应中只产生NO或NO 2)
解析: 因为1 mol Cu参加反应生成Cu (NO3)2对应2 mol HNO3 显酸性,所以25.6 mg Cu 完全反应,必然有0.8×10-3 mol 的硝酸显酸性,其余的硝酸中的氮全转移到NO或NO2中,即有1 mol HNO3 作氧化剂就有1 mol 氮的氧化物(NO或NO2)。答案13.44 mL.。
例6.将1.92 g 铜粉与一定量浓硝酸恰好完全反应,反应后收集到的气体在标准状况下的体积为 1120 mL。(假设反应中只产生NO或NO 2)则消耗硝酸的物质的量为 mol。
A. 0.12 B. 0.11 C.0.09 D.0.08
解析: 因为0.03 mol Cu 参加反应生成 Cu(NO3)2 对应 0.06 mol HNO3 显酸性,0.05 mol 氮的氧化物(NO或NO2)对应0.05 mol HNO3作氧化剂,所以共消耗硝酸0.11 mol。 答案 选B。
例7.为测定某铜银合金的成分,将30 g 合金完全溶解于80 mol、浓度为 13.5 mol/L的浓硝酸中,合金完全溶解后,收集到6.72 L(标准状况下)的气体 (假设反应中只产生NO或NO2),并测得溶液的pH=0 , 假设反应后溶液的体积仍80 mL。
(1)被还原的硝酸的物质的量.
(2)合金中各金属成分.
解析:(1)被还原的硝酸就是作氧化剂的硝酸,即生成的1 mol 氮的氧化物就对应 1 mol 被还原的硝酸:所以:
n=6.72/22.4=0.3 mol
(2)设合金中铜银的物质的量分别为x、y则显酸性的硝酸的物质的量为2x + y
因为PH=0则反应后溶液的氢离子浓度为1
64x+108y=30 ①
2x+y+6.72/22.4=0.08×13.5–0.08×1 ②(氮元素守恒)
解得x=0.3 y=0.1
例8.将6.4 g Cu与80 mol/L 60 mL 的硝酸充分反应,铜完全溶解,反应后溶液中的H+ 的物质的量为a mol.(假设反应中只产生NO或NO2),此时溶液中所含NO3-的物质的量为 mol。
A. 0.28 B. 0.31 C. a+0.2 D. a+0.4
解析: 6.4 g Cu反应后生成0.1 mol Cu (NO3)2,再加上 HNO3 中的 NO3- 。即得答案 C 。
金属与硝酸反应的实质是金属与H+和NO3- 共同作用.
例如:铜与稀硝酸反应的实质是:
3Cu +8H+ +2NO3- ===3Cu2+ +4H2O +2NO↑
Fe2+与稀硝酸反应的实质是:
3Fe2+ + 4H+ + NO3- === 3Fe3+ + 2H2O + NO↑
例 1.铜粉放入稀硫酸溶液后,加热后无明显现象发生,当加入下列一种物质后,铜粉质量减少,溶液呈蓝色,同时有气体产生,该物质可能是( ) 。
A. Fe2 (SO4) 3 B. Na2CO3 C. KNO3 D.FeSO4
解析: 铜不能与稀硫酸反应,但稀硫酸提供H+, 盐提供NO3-,构成强氧化条件,能溶解铜并产生气体。答案选 C。
例2.铁铜混合物加入不足量的硝酸,反应后,剩余金属m1 g,再向其中加入一定量稀硫酸.充分振荡后, 剩余金属m2 g, 则m1与m2的关系是( )。
A. m1一定大于m2 B. m1一定等于m2 C. m1可能等于m2 D. m1可能大于m2
解析: 铁铜混合物与不足量的硝酸反应后生成硝酸盐,即溶液中的盐含有NO3-,再加稀硫酸提供H+,发生氧化还原反应,会再溶解一部分金属。答案 选A。
例3.已知Fe2+可以水解: Fe2+ +2H2OFe(OH) 2+2H+,现向Fe(NO3) 2溶液中加入足量的稀硫酸,则溶液的颜色( ) 。
A. 浅绿色加深 B.颜色变浅 C.溶液变黄 D.无法判断
解析: 原Fe (NO3) 2溶液中含有NO3-,再加入稀硫酸提供H+,发生氧化还原反应
3Fe2+ + 4H+ + NO3- === 3Fe3+ + 2H2O + NO↑ 溶液变黄,答案 选 C
例4.在100 mL 混合溶液中, HNO3 和 H2SO4 的物质的量浓度分别是 0.4 mol/L, 0.1 mol/L 向该混合液中加入 1.92 g铜粉,加热待充分反应后,所得溶液中 Cu2+ 的物质的量浓度是( )。
A. 0.15 B. 0.225 C. 0.35 D. 0.45
解析: 题中告诉了HNO3和H2SO4的物质的量浓度,可以求出H+ 和NO3- 的物质的量分别是 0.06 mol, 0.04 mol, 0.03 mol Cu,显然要判断过量, NO3- 和Cu 过量.按照 H+ 的量代入离子方程式计算.答案 选B。
21.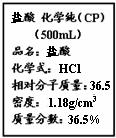 (8分) 右图为某市售盐酸试剂瓶标签上的部分数据。
(8分) 右图为某市售盐酸试剂瓶标签上的部分数据。
(1) 现用该浓盐酸配制200 mL 5 mol·L-1的稀盐酸。需要用量筒量取上述浓盐酸的体积为 ▲ mL。
(2)现把1.1 g铝、铁混合物溶于200 mL 5mol/L盐酸中,反应后H+ 的浓度变为4.6mol/L(溶液体积变化忽略不计)。
该混合物中铝、铁的物质的量分别是多少?
▲
西亭高级中学09-10学年高一上学期期末考试
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com