
3.右图反映了我国古代某一朝代的都城布局,该布局的出现应
该不晚于下列哪个朝代?
A.汉朝
B.隋朝
C.宋朝
D.明朝
2.李约瑟对古代中国科技作出这样的评价:“在中国完成的发明和技术发现,改变了西方文明的发展进程,并因而也确定改变了整个世界的发展进程。”以下可以支持这一观点的是
①火药推动了欧洲宗教改革 ②印刷术为文艺复兴准备了条件
 ③指南针使地理大发现成为可能
④造纸术方便了智者学派的研究
③指南针使地理大发现成为可能
④造纸术方便了智者学派的研究
 A. ③④
B. ①④
C. ①③
D. ②③
A. ③④
B. ①④
C. ①③
D. ②③
1.下图所示是四方古印文,联系秦朝的历史,我们可以得到的正确结论是

①秦朝创立皇帝制度 ②秦朝在中央设立丞相、御史大夫等职③秦朝在地方推行分封制 ④秦朝统一了文字
A.①②③ B.②③④
C.①②④ D.①③④
15.下表数据是在某高温下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录(表中a和b均为与温度有关的数据):
|
反应时间 t/h |
1 |
4 |
9 |
16 |
25 |
|
MgO层厚 y/nm |
0.05a |
0.20a |
o.45a |
0.80a |
1.25a |
|
NiO层厚y1/nm |
b |
2b |
3b |
4b |
5b |
⑴ 金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是: ;
⑵ 金属氧化膜的膜厚y和时间t所呈现的关系:MgO氧化膜厚y属 型,NiO氧化膜y1属 型(填“直线”,“抛物线”,“对数”或“双曲线”等类型)。
⑶ Mg和Ni比较,那一种金属具有更良好的耐氧化腐蚀性: ,其理由是: 。
14.将物质的量相等的A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率是0.1mol/(L·min),求:⑴ 此时A的浓度及反应开始前放入容器中A、B的物质的量;⑵ B的平均反应速率;⑶ x的值是多少?
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率是0.1mol/(L·min),求:⑴ 此时A的浓度及反应开始前放入容器中A、B的物质的量;⑵ B的平均反应速率;⑶ x的值是多少?
13.取2g干燥铝粉和3g碘粉小心混匀,分为四堆。往各堆上分别加0.5g水,1g明矾,1g胆矾,1g无水硫酸铜。加水那堆混合物首先冒火花,发生剧烈反应,其次发生反应的是加明矾的那一堆混合物,再次发生反应的是加胆矾的那一堆混合物,而加无水硫酸铜的那堆最难发生反应。
⑴ 铝和碘反应的方程式为 ;铝和碘反应还可以看到 ;
⑵ 四堆混合物发生反应的先后顺序说明 。
12.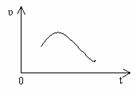 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1)和S(+6)
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1)和S(+6)
的反应速率如图4所示,已知这个反应速率随着溶液中c(H+)增大而加快。反应开始时反应速率加快的原因是__________________;
反应后期反应速率下降的原因是 。
11.对于4FeS2+1O2 ==2Fe2O3+8SO2,试回答有关的问题
① 常选用哪些物质浓度的变化来表示该反应的速率 ;
② 当生成SO2的速率为4mol/(L·S),则O2减少的速率是 ;
③ 测得4S后,O2的浓度为2.8mol/L,则开始时O2的浓度为 ;
④ 为了提高生成SO2的速率,可以采取的措施是
A.增加FeS2的量 B.增大O2的浓度 C. 升高温度 D.减小压强
9.100mL6mol/L硫酸溶液与过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不能影响生成氢气的总量,可向反应物中加入适量的
A.碳酸钠 B.水 C.硫酸钾溶液 D.硝酸钾溶液
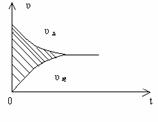 10.容积固定的2L密闭容器中进行的某一可逆反应
10.容积固定的2L密闭容器中进行的某一可逆反应
A(g)+2B(g) 2C(g),以B的物质的量浓度改变表示的反应
2C(g),以B的物质的量浓度改变表示的反应
速度v(正),v(逆)与时间的关系图如所示。已知反应速率v的
单位为mol·L-1·s-1,则图中阴影部分的面积可表示
A.A的物质的量浓度的减少 B.B的物质的量浓度的减少
C.C的物质的量增加 D.B的物质的量减少
8.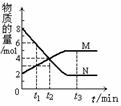 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
A.反应的化学方程式为:2M N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率 D.t1时,N的浓度是M浓度的2倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com